Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RSBO (Online)
versão On-line ISSN 1984-5685
RSBO (Online) vol.7 no.2 Joinville Jun. 2010
ARTIGO ORIGINAL DE PESQUISA ORIGINAL RESEARCH ARTICLE
Deslocamento axial de fluido em capilar de vidro, após a reação intracoronária de diversos agentes clareadores
Axial displacement of fluid in glass capillary after intracoronary reaction of several bleaching agents
Camila Almeida NascimentoI; Rafael Carlos MendesI; Milton Carlos KugaII; Arnaldo Sant'Anna JúniorII; Marco Antonio Hungaro DuarteIII; Antonio de Castro RodriguesIV
IAlunos de graduação da Fundação Municipal de Educação e Cultura de Santa Fé do Sul (SP)
IIProfessores de Endodontia da Fundação Municipal de Educação e Cultura de Santa Fé do Sul (SP)
IIIProfessor de Endodontia da Faculdade de Odontologia de Bauru/Universidade de São Paulo (USP)
IVProfessor do Departamento de Ciências Biológicas da Faculdade de Odontologia de Bauru/USP
RESUMO
INTRODUÇÃO E OBJETIVO: Buscou-se quantificar, indiretamente, a liberação de oxigênio após a reação química intracoronária, por deslocamento axial de fluido em capilares de vidro, adaptados em coroas dentárias.
MATERIAL E MÉTODOS: Coroas bovinas foram acessadas, e foi executado o tampão cervical e posicionado um capilar de vidro na face externa vestibular, contendo um veículo oleoso. Na sequência, foram preparadas quatro associações de clareadores e colocadas em seu interior: G1 – perborato de sódio e peróxido de hidrogênio a 3%; G2 – perborato de sódio e água; G3 – associação de percarbonato de sódio e peróxido de hidrogênio a 3%; G4 – associação de percarbonato de sódio e água destilada. Após serem mantidas por 24 horas, quantificou-se o deslocamento axial do fluido, interpretado como liberação de oxigênio pela reação química.
RESULTADOS: Os resultados mostraram uma tendência das associações com o peróxido de hidrogênio em promover maior liberação de oxigênio. Entretanto não houve diferença entre o perborato de sódio e o percarbonato de sódio (p > 0,05).
CONCLUSÃO: Os grupos experimentais não demonstraram diferenças entre si durante as 24 horas de reação química.
Palavras-chave: clareamento dental; peróxido de hidrogênio; perborato de sódio; percarbonato de sódio.
ABSTRACT
OBJETIVE: To indirectly quantify the release of oxygen after intracoronary chemical reaction, by axial displacement of fluid in glass capillaries arranged in dental crowns.
MATERIAL AND METHODS: Bovine crowns were accessed, the cervical plug was executed and a glass capillary was placed in the vestibular external face, containing an oily vehicle. Following that, four associations of bleaching were prepared and placed in its interior: G1 – sodium perborate and hydrogen peroxide 3%; G2 – sodium perborate and water, G3 – sodium percarbonate and hydrogen peroxide 3%; G4 – sodium percarbonate and distilled water. After being kept for 24 hours, the axial displacement of the fluid was quantified and interpreted as the release of oxygen by the chemical reaction.
RESULTS: The results showed a trend of the associations with hydrogen peroxide to promote the release of more oxygen. However, there was no difference between sodium perborate and sodium percarbonate (p > 0.05).
CONCLUSION: The experimental groups showed no differences between them during the 24 hours of chemical reaction.
Keywords: bleaching teeth; hydrogen peroxide; sodium perborate; sodium percarbonate.
Introdução
A manutenção da coloração original da coroa dentária após o tratamento endodôntico é esteticamente imprescindível. Entretanto em algumas situações o não desejado escurecimento pode ocorrer, em virtude de diversos fatores etiológicos [5].
Nessas condições, a recuperação da tonalidade poderá ser obtida com substâncias clarificantes de uso intracoronário, e o grupo dos peróxidos é o mais utilizado e indicado, agindo normalmente pelo sistema de oxidação e redução.
O peróxido de hidrogênio é empregado há muitos anos [8], principalmente associado ao calor por meio da técnica termocatalítica. Técnicas que geram menor agressividade aos tecidos periodontais são as preferidas atualmente, tais como as que adotam apenas uma combinação com perborato de sódio e água [16] ou com o Superoxol (peróxido de hidrogênio a 35%), sem a simultânea aplicação de calor.
O perborato de sódio é estável em estado sólido, com peso molecular de 153,88 (g/mL), e misturado à água transforma-se em metaborato de sódio, peróxido de hidrogênio e oxigênio [5]. De característica similar há o percarbonato de sódio, de peso molecular 314,02 (g/mL), que consiste na associação de carbonato de sódio com peróxido de hidrogênio, o qual, ao entrar em contato com água, rapidamente libera oxigênio e sódio, de modo a aumentar o pH do local e reduzir a atividade dos íons cálcio e magnésio.
O mecanismo preciso do clareamento coronário é controverso, mas sabe-se que todos os produtos químicos envolvidos são altamente instáveis e reagentes [1]. O peróxido de hidrogênio promove o rompimento de longas cadeias moleculares orgânicas e, por conseguinte, ligações iônicas, o que provoca alteração de energia em sua coloração, ocasionando um clareamento das estruturas.
Assim, a liberação de oxigênio é imprescindível para que a clareação ocorra independentemente do material empregado ou da técnica utilizada. Entretanto percebe-se que há escassez de informações de qual método produz maior atividade química.
Dessa forma, por intermédio de um recurso indireto, foi avaliada a associação que permite maior atividade reacional química intracoronária, com liberação de oxigênio.
Material e métodos
Quarenta coroas de incisivos foram obtidas de dentes bovinos, mediante a secção transversal no nível da junção amelocementária, com auxílio de disco de carborundum acionado em baixa rotação.
A abertura coronária foi realizada com uma ponta diamantada 1014 (KG Sorensen, São Paulo, SP, Brasil), seguindo os princípios recomendados por Burns e Herbranson (2002) [3]. Na cervical da coroa dentária, foi colocado um tampão cervical com o ionômero de vidro (Vidrion R, SS White, Rio de Janeiro, RJ, Brasil) de aproximadamente 2,0 mm de espessura, de tal forma que vedasse toda a abertura correspondente ao perímetro do canal radicular.
Após a execução das aberturas coronárias, um orifício foi realizado no centro da face vestibular das coroas dentárias, com a ponta diamantada 1014, comunicando com o interior da câmara pulpar (figura 1). Nesse local foi adaptado e colado com cola epóxi (Scotch-bond, 3M, São Paulo, SP, Brasil) um capilar de vidro de 75 mm de comprimento com 1,0 mm de diâmetro interno por 1,5 mm de diâmetro externo, de maneira que uma de suas extremidades ficasse rente à dentina da câmara pulpar.
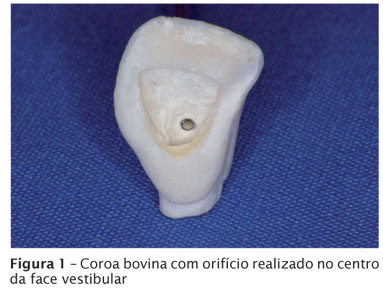
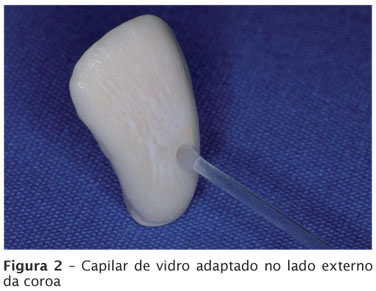
Na sequência, do lado externo radicular, tanto ao redor do capilar de vidro como na porção cervical foram aplicadas duas camadas de silicone de vedação (Brascoved, Brascola, São Bernardo do Campo, SP, Brasil), objetivando vedar o local adequadamente. No outro extremo do capilar a abertura foi mantida aberta. A figura 2 mostra o capilar de vidro adaptado no lado externo da coroa.
A câmara pulpar foi, então, preenchida com EDTA trissódico a 17% (Inodon, Porto Alegre, RS, Brasil) por 3 minutos e posteriormente lavada com 2 mL de água destilada e seca com jato de ar. Os capilares de vidro foram totalmente preenchidos com fluido automotivo (Lubrax DT SAE 30, Petrobras S.A., Duque de Caxias, RJ, Brasil).
Nesse momento, espécimes foram divididos em quatro grupos (n = 10), de acordo com o tipo de associação de agentes químicos a serem avaliados: G1 – perborato de sódio (Whiteness perborato, Dentscare Ltda., Joinville, SC, Brasil) associado a peróxido de hidrogênio a 3% (Rioquímica, São José do Rio Preto, SP, Brasil); G2 – perborato de sódio (Whiteness perborato, Dentscare Ltda., Joinville, SC, Brasil) associado a água destilada; G3 – composto à base de percarbonato de sódio (Reckitt Beckiser, São Paulo, SP, Brasil) associado a peróxido de hidrogênio 3%; G4 – composto à base de percarbonato de sódio (Reckitt Beckiser, São Paulo, SP, Brasil) associado a água destilada. Em todos os grupos a associação, em peso e volume, foi de 45 mg de pó agregado a 0,5 mL do líquido.
Colocaram-se as misturas no interior das câmaras pulpares, as quais foram preenchidas até 2 mm aquém da borda da abertura coronária e posteriormente vedadas com o cimento de ionômero de vidro IRM (Dentsply Ind. e Com. Ltda., Petrópolis, RJ, Brasil), e sobre ele também foi passado o silicone de vedação. Todos os espécimes foram mantidos de tal forma que o capilar ocupasse sempre a posição horizontal e paralela com a superfície plana em que as coroas estavam apoiadas.
Após um dia de manutenção do curativo intracoronário, os capilares foram removidos das coroas dentárias e fotografados com uma máquina digital Pentax IST-Di com lente macro 105 mm, f/2.8 AE EX. Por intermédio do programa Image Tool (UTHSCSA Image Tool for Windows version 3.0, San Antonio, TX, EUA), devidamente calibrado para mensurar em milímetros, as imagens foram analisadas, e mediu-se o remanescente do fluido nos capilares.
Interpretou-se que, quanto menor a quantidade de fluido presente, maior teria sido a liberação de oxigênio pela reação química entre os agentes clarificantes. Ou seja, a análise estatística foi aplicada sobre a medida obtida do remanescente de fluido subtraído de 75 mm, que corresponde ao comprimento total do capilar. Os dados foram submetidos à análise de Kruskal Wallis, em nível de significância de 5%.
Resultados
As médias de deslocamento propiciado pelos grupos foram: G1 (perborato de sódio associado a peróxido de hidrogênio) = 15,08 mm; G2 (perborato de sódio associado a água) = 12,17 mm; G3 (composto do percarbonato de sódio associado a peróxido de hidrogênio) = 16,41 mm; G4 (composto de percarbonato de sódio associado a água) = 13,46 mm.
Os dados obtidos foram submetidos ao teste não paramétrico de Kruskal Wallis, não demonstrando significância estatística entre os grupos experimentais (p > 0,05), muito embora tenha sido observada uma discreta tendência dos grupos que utilizaram a associação com o peróxido de hidrogênio a produzir maior deslocamento do fluido dos capilares, interpretado indiretamente como uma maior liberação de oxigênio pela reação química.
O gráfico 1 ilustra a média de deslocamento do fluido, nos capilares de vidro, em função dos tipos de agentes empregados no clareamento intracoronário. A média de maior deslocamento de fluido foi proporcionada pela associação do composto de percarbonato de sódio com peróxido de hidrogênio a 3% (16,41 mm); já o menor ocorreu para o perborato de sódio associado a água destilada (12,17 mm). Porém entre os grupos não se observaram diferenças significantes (p > 0,05).
Discussão
A clareação coronária de dentes tratados endodonticamente ainda é cercada de controvérsias, desde os métodos com que deve ser executada até quais são as eventuais complicações e riscos capaz de ocasionar ao próprio dente e às estruturas periodontais adjacentes [14].
Atualmente têm sido evitados os meios que empregam o calor para a catálise das reações com o peróxido de hidrogênio, em decorrência de possíveis reabsorções radiculares [17].
Nesse propósito, Nutting e Poe (1967) [12] propuseram o método ambulatorial de recuperação da coloração coronária, associando o perborato de sódio ao peróxido de hidrogênio. Esse composto pode ter a sua ação atenuada se o peróxido de hidrogênio for substituído pela água destilada [16]. Assim, especificamente com relação a dentes tratados endodonticamente, pode-se utilizar o perborato de sódio tanto com água destilada como com peróxido de hidrogênio [2].
Em períodos de observação após 14 dias de inserção intracoronária das misturas, independentemente do uso de água destilada, peróxido de hidrogênio a 3% ou a 30%, não houve diferença entre os processos [4, 15, 19], embora Yui et al. (2008) [20] tenham demonstrado que o peróxido de carbamida a 10% ou 35% foi mais efetivo que a água destilada na clareação de dentes tratados endodonticamente.
Outros substitutos de agentes clarificantes já foram sugeridos, entre eles combinações enzimáticas, tais como amilase, lipase e tripsina associadas ao EDTA dissódico [12], sem apresentar superioridade às técnicas tradicionais.
Essencialmente o produto final que gera o clareamento coronário é o oxigênio, seja ele oriundo da degradação do perborato de sódio ou diretamente do peróxido de hidrogênio. Uma forma alternativa consiste no uso de outro produto que após as reações químicas também produza oxigênio, sendo sugestivo o percarbonato de sódio, que possui ação na presença de cálcio e magnésio, conhecido como "água dura" [10, 13].
A medição e a quantificação de gases, especialmente o oxigênio, proveniente da reação química ocasionada nos clarificantes, são complexas. Um estudo recente [6] constatou que o oxigênio pode ser quantificado diretamente pelo uso de uma ponta de rutênio adaptada em coroas bovinas.
Nesta pesquisa, idealizamos um método indireto que permite quantificar a produção por meio da difusão radial de um fluido, em capilares de vidro devidamente instalados na coroa dentária.
Todos os grupos experimentais apresentaram deslocamento do fluido insignificante entre si (p > 0,05). A opção por efetuar avaliação somente nas primeiras 24 horas deveu-se ao fato de provavelmente as reações químicas de produção de oxigênio ocorrerem de maneira mais intensa nesse período.
Os grupos que utilizaram os peróxidos de hidrogênio, independentemente de estarem associados ao perborato ou ao percarbonato de sódio, tiveram maior tendência de ocasionar o deslocamento; isso, por conseguinte, foi interpretado como maior produção inicial de oxigênio, em concordância com os achados de Ho e Goerig (1989) [9].
O valor quantitativo de produção de oxigênio e a técnica de combinação dos materiais aparentemente não implicam melhor resposta clarificante [7], porém observa-se que a associação com os peróxidos ao perborato, em avaliações de longo prazo, é mais eficaz [9].
Embora sem diferenças significantes, o resultado leva a crer que, em relação à liberação de oxigênio, a associação com o peróxido de hidrogênio no período de 24 horas obteve maior efetividade de ação. Há necessidade de mais estudos que quantifiquem a liberação do oxigênio e de outros subprodutos da reação dos peróxidos aos perboratos e percarbonatos.
Conclusão
Diante do exposto nesta pesquisa e metodologia, achamos oportuno concluir que:
• os grupos experimentais não diferiram entre si no que se refere ao deslocamento axial do fluido, após a reação intracoronária dos agentes clareadores (p > 0,05);
• houve uma discreta tendência de os grupos associados ao peróxido de hidrogênio a 3% ocasionarem maior deslocamento do fluido, porém sem diferença estatística (p > 0,05).
Referências
1. Andrade MF, Huck C, Flores VHO. Clareamento dental. O clareamento à luz da ciência. In: Leonardo MR. Endodontia. Tratamento de canais radiculares. Princípios técnicos e biológicos. São Paulo: Artes Médicas; 2008. p. 1.326-72. [ Links ]
2. Ari H, Üngör M. In vitro comparison of different types of sodium perborate used for intracoronal bleaching of discoloured teeth. Int Endod J. 2002;35:433-6. [ Links ]
3. Burns RC, Herbranson EJ. Tooth morphology and cavity preparation. In: Cohen S, Burns RC. Pathways of the pulp. St. Louis: Mosby; 2002. p. 173-229. [ Links ]
4. Carrasco LD, Froner IC, Corona SAM, Pécora JD. Effect of internal bleaching agents on dentinal permeability of non-vital teeth: quantitative assessment. Dental Traumatol. 2003;19:85-9. [ Links ]
5. De Deus QD. Endodontia. 5ª ed. Rio de Janeiro: Medsi; 1992. p. 627-40. [ Links ]
6. Florez FLE, Vollet-Filho JD, Oliveira-Junior OB, Bagnato VS. Time-course diffusion of hydrogen peroxide using modern technologies. Disponível em: http://www.iadr.confex.com/iadr/2008Toronto/techprogram/abstract_106525.htm. [ Links ]
7. Freccia WF, Peters DD, Lorton L, Bernier WE. An in vitro comparison of nonvital bleaching techniques in the discolored tooth. J Endod. 1982;8:70-7. [ Links ]
8. Haywood VB. History, safety and effectiveness of current bleaching techniques and applications of the nightguard vital bleaching technique. Quintessence Int. 1992;23:471-88. [ Links ]
9. Ho S, Goerig AC. An in vitro comparison of different bleaching agents in the discolored tooth. J Endod. 1989;15:106-11. [ Links ]
10. Kaneko J, Inoue S, Kawakami S, Sano H. Bleaching effect of sodium percarbonate on discolored pulpless teeth in vitro. J Endod. 2000;26:25-8. [ Links ]
11. Marin PD, Heithersay GS, Bridges TE. A quantitative comparison of traditional and non-peroxide bleaching agents. Dental Traumatol. 2007;14:64-7. [ Links ]
12. Nutting EB, Poe GS. Chemical bleaching of discolored endodontically treated teeth. Dent Clin North Am. 1967;11:655-62. [ Links ]
13. Percarbonato de sódio. Disponível em: http://www.sbrt.ibict.br. [ Links ]
14. Plotino G, Buono L, Grande NM, Pameijer CH, Somma F. Nonvital tooth bleaching: a review of the literature and clinical procedures. J Endod. 2008;34:394-407. [ Links ]
15. Rotstein I, Friedman S, Mor C, Katznelson J, Sommer M, Bab I. Histological characterization of bleaching-induced external root resorption in dogs. J Endod. 1991;17:436-41. [ Links ]
16. Spasser HF. A simple bleaching technique using sodium perborate. NY State Dent J. 1961;27:352. [ Links ]
17. Sun G. The role of lasers in cosmetic dentistry. Dent Clin North Am. 1998;44:831-49. [ Links ]
18. Wang JD, Hume WR. Diffusion of hydrogen ion and hydroxyl ion from various sources through dentine. Int Endod J. 1988;21:17-26. [ Links ]
19. Weiger R, Kuhn A, Löst C. In vitro comparison of various types of sodium perborate used for intracoronal bleaching of discolored teeth. J Endod. 1994;20:338-41. [ Links ]
20. Yui KCK, Rodrigues JR, Mancini MNG, Balducci I, Gonçalves SEP. Ex vivo evaluation of the effectiveness of bleaching agents on the shade alteration of blood-stained teeth. Int Endod J. 2008;41:485-92. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Milton Carlos Kuga
Avenida Saul Silveira, 5-01 – Residencial Paineiras
CEP 17018-260 – Bauru – SP
E-mail: miltoncarloskuga@hotmail.com
Recebido em 10/7/2009
Aceito em 19/10/2009
Received on July 10, 2009
Accepted on October 19, 2009













