Serviços Personalizados
Artigo
Links relacionados
Compartilhar
RSBO (Online)
versão On-line ISSN 1984-5685
RSBO (Online) vol.7 no.3 Joinville Set. 2010
ARTIGO ORIGINAL DE PESQUISA ORIGINAL RESEARCH ARTICLE
Determinação do pH, capacidade de tamponamento, carboidratos totais e sacarose em sucos de fruta industrializados "zero açúcar" e light
Determination of pH, buffering capacity, total carbohydrates and sucrose in sugar-free and light processed fruit juices
Andressa de Marchi El Assad; Juliana Dal Molin Netto; Estela Maris Losso; Maria Fernanda Torres; João Armando Brancher
Departamento de Odontologia, Universidade Positivo – Curitiba – PR – Brasil
RESUMO
INTRODUÇÃO: Erosão dentária é a perda irreversível dos tecidos dentários duros causada por ácidos e/ou quelação química sem envolvimento bacteriano. Vários estudos mostraram que há um aumento de sua prevalência em crianças, jovens e adultos e associam a erosão dentária ao consumo de bebidas ácidas, incluindo sucos de fruta industrializados.
OBJETIVO: O objetivo deste estudo foi avaliar o pH, a capacidade de tamponamento (CT) e a quantidade de carboidratos totais e de sacarose em 15 sucos de fruta light ou "zero açúcar".
MATERIAL E MÉTODOS: O pH foi verificado com auxílio de um potenciômetro Mettler Toledo 320. A CT foi estipulada por titulometria, gotejando-se NaOH 0,1 N em amostras de cada suco até que o pH delas atingisse 7,0. Os carboidratos totais foram determinados pelo método do fenolsulfúrico, e a sacarose, incubando-se cada amostra de bebida com a enzima invertase.
RESULTADOS: O valor médio de pH encontrado foi de 2,61 (±0,29). Os sucos analisados necessitaram, em média, de 6,2 mL (±1,9) de NaOH 0,1N para elevar o pH até 7,0. Os carboidratos totais observados nas análises foram condizentes com os valores descritos nas embalagens. O conteúdo de sacarose verificado em cada bebida foi muito pequeno e variou de 0,60 a 0,93 g / 200 mL.
CONCLUSÃO: Este estudo mostrou que as 15 bebidas avaliadas tinham pH extremamente baixo e potencial erosivo, uma vez que a maioria dos sucos apresentou alta capacidade de tamponamento. A quantidade de sacarose presente em cada bebida é muito pequena, sugerindo que não são cariogênicas. Entretanto são necessários estudos futuros que demonstrem a ação dessas bebidas sobre a superfície dentária.
Palavras-chave: sucos de fruta; erosão dentária; pH.
ABSTRACT
INTRODUCTION: Tooth erosion is the irreversible loss of dental hard tissues caused by acids and/or chelation without bacterial involvement. Many studies showed that there is an increase of tooth erosion in population and that it is related to the consumption of soft drinks, including processed fruit juices.
OBJECTIVE: The aim of this study was to evaluate the pH, buffering capacity (BC), total carbohydrates and sucrose in 15 sugar-free and light processed fruit juices.
MATERIAL AND METHODS: The pH was determined with a Mettler Toledo 320 pH meter. The BC was determined by titration, adding 0.1 N NaOH in 10 mL of each drink until reaching a pH level of 7.0. The total carbohydrates were determined using the phenol sulfuric method, while the sucrose was determined through the incubation of each sample with the invertase enzyme.
RESULTS: The average value of pH was 2.61 (±0.29). The processed fruit juices analyzed needed, in average, 6.2 mL (±1.9) of NaOH in order to increase the pH to 7.0. The total carbohydrates showed to be according to the values presented in the labels. The sucrose content verified in each drink was very low and varied from 0.60 to 0.93 g / 200 mL.
CONCLUSION: This study showed that the 15 drinks analyzed had low pH and erosive potential, once most juices presented high BC. The sucrose presented in each drink was very low, suggesting that they are not cariogenic. Nevertheless, further studies that demonstrate the action of these juices in the dental surface are required.
Keywords: fruit juices; tooth erosion; pH.
Introdução
Erosão dentária é a perda irreversível dos tecidos dentários duros causada por ácidos e/ou quelação química sem envolvimento bacteriano [23]. Ácidos gástricos e ácidos provenientes da dieta ou do meio ambiente são os principais fatores etiológicos [10, 30], entretanto é considerada uma condição multifatorial [18]. Nos últimos anos houve maior interesse de clínicos e pesquisadores sobre o mecanismo de desenvolvimento da erosão dentária em virtude do aumento de sua prevalência em crianças [24], jovens e adultos [17].
Segundo alguns autores, essa elevação está diretamente associada com a baixa capacidade de tamponamento salivar e a ingestão de bebidas e alimentos que contêm ácidos orgânicos em excesso [25]. Estudos anteriores em humanos já haviam mostrado a relação entre erosão dentária e consumo de alimentos e bebidas ácidas, incluindo sucos de fruta e refrigerantes, entre outros [12].
Deve-se destacar também que, além da erosão dentária, bebidas que contenham açúcares também são cariogênicas, uma vez que carboidratos fermentáveis podem modificar bioquimicamente o biofilme bacteriano presente sobre as superfícies dentárias, aumentando a produção de ácidos nele e iniciando o processo de desmineralização [5, 31].
Ao contrário da erosão dentária, a prevalência de cárie tem diminuído significativamente na Europa e na América Latina, incluindo o Brasil [3, 20, 21]. Alguns autores sugerem que essa redução esteja relacionada com programas de saúde bucal, maior utilização de fluoretos [13, 21, 29] e diminuição do consumo de carboidratos fermentáveis [22], que também contribui para a modificação do biofilme bacteriano, deixando-o menos cariogênico [31]. Talvez por isso exista uma oferta crescente de vários sucos de fruta industrializados light ou "zero açúcar", cujo principal apelo comercial é exatamente a ausência de açúcares. Não há na literatura trabalhos que investiguem as propriedades desses sucos, portanto o objetivo deste estudo foi avaliar o pH, a capacidade de tamponamento (CT) e a quantidade de carboidratos totais e de sacarose em 15 sucos de fruta light e "zero açúcar".
Material e métodos
Quinze sucos de fruta light ou "zero açúcar" adquiridos em estabelecimentos comerciais de Curitiba (PR) foram escolhidos para esta pesquisa. Em cada bebida foram determinados o pH, a capacidade tampão (CT), carboidratos totais e sacarose. O pH foi verificado imediatamente após a abertura das embalagens, com auxílio de um potenciômetro da marca Mettler Toledo 320 previamente calibrado com soluções cujo pH era 4,0, 7,0 e 8,0. A CT foi estipulada pelo monitoramento do pH após adição de NaOH 0,1 N a 10 mL de cada bebida até que o pH atingisse 7,0. Os carboidratos totais foram determinados pelo método do fenolsulfúrico [6]. Para averiguar a quantidade de sacarose presente em cada bebida foi utilizada a metodologia descrita por Ekunsanmi e Odunfa [7], na qual se incuba uma amostra da bebida com a enzima invertase e se adiciona dinitrossalicilato. A leitura das amostras foi realizada em espectrofotômetro a 540 nanômetros. Todos os testes foram feitos em triplicata para maior confiabilidade nos resultados obtidos.
Resultados
A tabela I mostra os sucos de fruta analisados e os valores de pH, CT, carboidratos totais e sacarose encontrados em cada bebida. Os valores de pH variaram entre 2,12 e 3,01, e a média encontrada foi de 2,61 (± 0,29). As bebidas avaliadas necessitaram, em média, de 6,2 mL (±1,9) de NaOH 0,1N para elevar o pH até 7,0. Observou-se que os sucos Fruthos Maracujá Light, Top Fruit Laranja Zero Açúcar e Fruthos Uva Light foram os que mais utilizaram NaOH para neutralizar o pH – respectivamente 8,3 mL, 6,5 mL e 6,0 mL. Objetivamente, quanto menor o pH e maior a quantidade de NaOH usada para neutralizá-lo, maior é o poder erosivo da bebida.
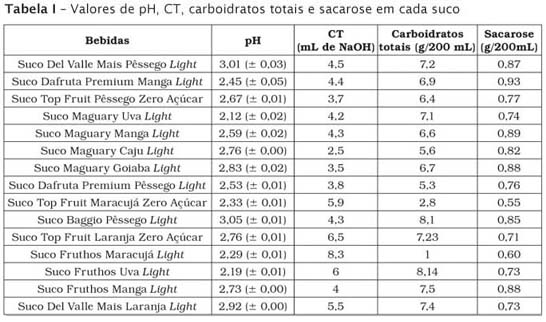
Os carboidratos totais encontrados nas análises foram condizentes com os valores descritos nas embalagens, e as pequenas variações observadas não foram significativas. O conteúdo de sacarose verificado em cada bebida também mostrou ser muito pequeno e variou de 0,60 a 0,93 g/200 mL.
Discussão
Quando uma bebida é ingerida, logo entra em contato com as superfícies dentais que, em condições normais, são recobertas por uma película de origem salivar composta por íons e proteínas salivares. Tanto proteínas quanto íons salivares exercem funções importantíssimas, entre elas a capacidade de manter o pH bucal nos limites normais [8, 9].
Ao consumir bebidas com baixo pH e elevada capacidade de tamponamento haverá uma diminuição acentuada do pH da cavidade bucal, o que pode ocasionar perda das funções da saliva e aumento na dissolução da apatita dentária [17, 32].
O estudo de Corso et al. [4] indica que bebidas com pH inferior a 5,5 já podem causar erosão dentária, principalmente se o consumo delas for frequente. Já Westergaard et al. [32] sugerem que bebidas com pH abaixo de 4,0 são capazes de afetar as funções salivares, especialmente a capacidade de tamponamento, contribuindo para aumentar a solubilidade da apatita dentária.
Neste estudo todas as bebidas light e "zero açúcar" analisadas apresentaram pH extremamente baixo, compatível com valores que podem causar erosão dentária. Eles variaram entre 2,12 e 3,01, com valor médio de 2,61 (± 0,29), e são ainda mais baixos do que o pH de sucos de fruta industrializados que contêm açúcar [14].
É importante destacar que o poder erosivo de uma bebida pode ser minimizado caso existam nela flúor e outros minerais. Lussi et al. [15, 16] e Mahoney et al. [19] encontraram uma correlação inversa entre poder erosivo e concentração de flúor nas bebidas analisadas. No presente trabalho, não foi quantificado o flúor nas bebidas.
Várias pesquisas têm demonstrado que o potencial erosivo de uma bebida ou de um alimento ácido não depende só do valor de pH, mas também é determinado fortemente pela capacidade de tamponamento [1, 2, 11]. Assim, bebidas que contenham ácidos tais como ácido cítrico, ascórbico e tartárico em pequenas quantidades exibem uma baixa capacidade de tamponamento e são rapidamente neutralizadas pelos tampões salivares, o que impede a queda prolongada do pH bucal, provocando portanto menor perda mineral na estrutura dentária [28].
Neste estudo o suco Fruthos Maracujá Light necessitou de 8,3 mL de NaOH 0,1 N para que seu pH atingisse 7,0, sendo portanto o suco que ao ser consumido demoraria mais tempo para ser neutralizado pelos tampões salivares. Entre as bebidas analisadas, esta é a que possui maior capacidade de tamponamento e maior poder erosivo, uma vez que seu pH também é baixo.
Tanto a erosão dentária quanto a cárie estão relacionadas com os hábitos alimentares das pessoas, e seu impacto sobre a vida destas é significante, uma vez que resulta em perda de dentes, dor, ausência da escola ou trabalho e piora na qualidade de vida [8, 33].
A cárie dentária, embora tenha declinado recentemente [3, 20, 21], continua sendo um dos maiores problemas de saúde pública do mundo [33] e está diretamente relacionada com o consumo de carboidratos fermentáveis, especialmente a sacarose [5].
A quantidade de sacarose verificada nesta investigação revela que sua dosagem é muito pequena. Variou entre 0,60 e 0,93 g/200 mL, o que por si só não representa risco de cárie. O conteúdo de carboidratos totais observado está muito próximo do descrito nas embalagens, e estes não podem ser considerados cariogênicos, pois estudos in vivo que monitoraram a produção de ácidos no biofilme bacteriano após o consumo de outros carboidratos que não sejam especificamente a sacarose encontraram níveis pequenos de cárie dentária [22, 26, 27].
Apesar de a erosão dentária ser uma condição multifatorial, sem dúvida um elemento determinante é o consumo frequente de alimentos ou bebidas que contenham ácidos. Também é indiscutível que, para evitar a progressão dela, se faz importante diagnosticá-la o mais cedo possível e promover a alteração dos hábitos alimentares das pessoas afetadas. Considerando o grande número de pessoas que consomem bebidas industrializadas ligth ou "zero açúcar" e os estudos que indicam o poder erosivo destas, o profissional da área de saúde deve estar atento e orientar seus pacientes e familiares quanto ao consumo racional de tais bebidas.
Conclusão
O presente trabalho mostrou que os 15 sucos analisados possuem pH extremamente baixo e potencial erosivo, uma vez que a maioria deles apresentou alta capacidade de tamponamento. A quantidade de sacarose existente em cada bebida é muito pequena, sugerindo que não são cariogênicas. Entretanto são necessários estudos futuros que demonstrem a ação dessas bebidas sobre a superfície dentária.
Referências
1. Bartlett D. The implication of laboratory research on tooth wear and erosion. Oral Dis. 2005;11:3-6. [ Links ]
2. Beiraghi S, Atkins S, Rosen S, Wilson S, Odom J, Beck M. Effect of calcium lactate in erosion and S. mutans in rats when added to Coca-Cola. Ped Dent. 1989;11:312-5. [ Links ]
3. Bönecker M, Cleaton-Jones P. Trends in dental caries in Latin American and Caribbean 5-6- and 11-13-year-old children: a systematic review. Community Dent Oral Epidemiol. 2003;31(2):152-7. [ Links ]
4. Corso AC, Hugo FN, Padilha DM. Ph e tiratibilidade de sucos artificiais de limão. Rev Fac Odontol Porto Alegre. 2002;43:30-3. [ Links ]
5. Cury JA, Rebelo MA, Del Bel Cury AA, Derbyshire MT, Tabchoury CP. Biochemical composition and cariogenicity of dental plaque formed in the presence of sucrose or glucose and fructose. Caries Res. 2000;34:491-7. [ Links ]
6. Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. Colorimetric method for determination of sugars and related substances. Anal Chem. 1956;28(3):350-6. [ Links ]
7. Ekunsanmi TJ, Odunfa SA. Ethanol tolerance, sugar tolerance and invertase activities of some yeast strains isolated from steep water of fermenting cassava tubers. J Appl Bacteriol. 1990;69:672-5. [ Links ]
8. Fejerskov O. Changing paradigms in concepts on dental caries: consequences for oral health care. Caries Res. 2004;38(3):182-9. [ Links ]
9. Hannig C, Hannig M, Attin T. Enzymes in the acquired enamel pellicle. Eur J Oral Sci. 2005;113:2-13. [ Links ]
10. Hefferren JJ. Why is there and should there be more attention paid to dental erosion? Compend Contin Educ Dent. 2004;25(9):4-8. [ Links ]
11. Holloway PJ, Mellanby M, Stewart RJC. Fruit drinks and tooth erosion. Br Dent J. 1958;104:305-9. [ Links ]
12. Järvinen VK, Rytömaa II, Heinonen OP. Risk factors in dental erosion. J Dent Res. 1991;70(6):942-7. [ Links ]
13. Krasse B. The caries decline: is the effect of fluoride toothpaste overrated? Eur J Oral Sci. 1996;104(4):426-9. [ Links ]
14. Losso EM, Silva JYB, Brancher JA. Análise do pH, acidez e açúcares totais de sucos de frutas industrializados. Arq Odonto. 2008;44:37-41. [ Links ]
15. Lussi A, Jaeggi T, Schärer S. The influence of different factors on in vitro enamel erosion. Caries Res. 1993;27(5):387-93. [ Links ]
16. Lussi A, Jaeggi T, Jaeggi-Schärer S. Prediction of the erosive potential of some beverages. Caries Res. 1995;29:349-54. [ Links ]
17. Lussi A, Schaffner M. Progression of and risk factors for dental erosion and wedge-shaped defects over a 6-year period. Caries Res. 2000;34(2):182-7. [ Links ]
18. Lussi A (Ed.). Dental erosion: from diagnosis to therapy. Monographs in Oral Science. Basel, Switzerland: Karger; 2006. p. 1-219. [ Links ]
19. Mahoney E, Beattie J, Swain M, Kilpatrick N. Preliminary in vitro assessment of erosive potential using the ultra-micro-indentation system. Caries Res. 2003;37:218-24. [ Links ]
20. Marthaler TM, O'Mullane DM, Vrbic V. The prevalence of dental caries in Europe 1990-1995. Caries Res. 1996;30(4):237-55. [ Links ]
21. Narvai PC, Frazão P, Castellanos RA. Declínio na experiência de cárie em dentes permanentes de escolares brasileiros no final do século XX. Odontol Saúde. 1999;1(1/2):25-9. [ Links ]
22. Newbrun E, Hoover C, Mettraux G, Graf H. Comparison of dietary habits and dental health of subjects with hereditary fructose intolerance and control subjects. J Am Dent Assoc. 1980;101(4):619-26. [ Links ]
23. Nunn JH. Prevalence of dental erosion and the implications for oral health. Eur J Oral Sci. 1996;104(2):156-61. [ Links ]
24. Nunn JH, Gordon PH, Morris AJ, Pine CM, Walker A. Dental erosion: changing prevalence? A review of British national children's surveys. Int J Paediatr Dent. 2003;13(2):98-105. [ Links ]
25. O'Sullivan EA, Curzon MEJ. A comparison of acidic dietary factors in children with and without dental erosion. J Dent Child. 2000;78:186-92. [ Links ]
26. Rugg-Gunn AJ, Hackett AF, Appleton DR, Jenkins GN, Eastoe JE. Relationship between dietary habits and caries increment assessed over two years in 405 English adolescent schoolchildren. Arch Oral Biol. 1984;29(1):983-92. [ Links ]
27. Rugg-Gunn AJ, Hackett AF, Appleton DR. Relative cariogenicity of starch and sugars in a 2-year longitudinal study of 405 English schoolchildren. Caries Res. 1987;21(5):464-73. [ Links ]
28. Rytömaa I, Meurman JH, Koskinen J, Laakso T, Gharazi L, Turunen R. In vitro erosion of bovine enamel caused by acidic drinks and other foodstuffs. Scand J Dent Res. 1988;96(4):324-33. [ Links ]
29. Splieth CH, Nourallah AW, Konig KG. Caries prevention programs for groups: out of fashion or up to date? Clin Oral Investig. 2004;8(1):6-10. [ Links ]
30.Ten Cate JM, Imfeld T. Dental erosion: summary. Eur J Oral Sci. 1996;104:241-4. [ Links ]
31. Van Houte J. Role of micro-organisms in caries etiology. J Dent Res. 1994;73:672-81. [ Links ]
32. Westergaard J, Moe D, Pallesen U, Holmen L. Exaggerated abrasion/erosion of human dental enamel surfaces: a case report. Scand J Dent Res. 1993;101:265-9. [ Links ]
33. Who Oral Health Country/Area Profile Programme. CAPP [accessed 2008 Dec 8]. Available from: http://www.whocollab.od.mah.se/index.html. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
João Armando Brancher
Rua Venezuela, 54 – Bacacheri
CEP 82510-100 – Curitiba – PR
E-mail: brancher@up.edu.br
Recebido em 18/3/2010
Aceito em 23/4/2010
Received on March 18, 2010
Accepted on April 23, 2010













