Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Innovations Implant Journal
versão On-line ISSN 1984-5960
Innov. Implant. J., Biomater. Esthet. (Online) vol.5 no.1 São Paulo Jan./Abr. 2010
ARTIGOS CIENTÍFICOS
Avaliação da hidroxiapatita contendo estrôncio como substituto ósseo em tíbias de ovelhas
Evaluation of strontium containing hydroxyapatite as bone substitute in sheep's tibia
Callinca Paolla Gomes MachadoI; Andrea Vaz Braga PintorII; Maria Alice Kuster de Albuquerque GressIII; Alexandre Malta RossiIV; José Mauro GranjeiroV; Mônica Diuana Calasans MaiaVI
IEspecialista em Periodontia, Associação Brasileira de Odontologia Militar, Rio de Janeiro, RJ, Brasil
IIEspecialista em Dentística, Faculdade de Odontologia – Centro de Pós-Graduação São Leopoldo Mandic, Campinas, SP, Brasil
IIIMestre em Clínica e Reprodução Animal, Universidade Federal Fluminense, Niterói, RJ, Brasil
IVDoutorado em Física, Centro Brasileiro de Pesquisas Físicas, Rio de Janeiro, RJ, Brasil
VProfessor Adjunto do Departamento de Biologia Celular e Molecular, Instituto de Biologia, Universidade Federal Fluminense, Niterói, RJ, Brasil. Professor Visitante da Faculdade de Odontologia de Bauru, Universidade de São Paulo, Bauru, SP, Brasil
VIDoutora em Patologia. Professora da Disciplina de Cirurgia Bucal, Departamento de Odontoclínica, Universidade Federal Fluminense, Niterói, RJ, Brasil
RESUMO
Com o avanço das pesquisas em biomateriais, tem sido sugerido que a melhor osteocondutividade da hidroxiapatita seria alcançada se o seu cristal estivesse mais próximo da estrutura, tamanho e morfologia da apatita biológica, por isso a nano-hidroxiapatita (nano-HA) é de grande interesse atual. Os íons estrôncio são conhecidos por reduzir a reabsorção óssea, induzir a atividade osteoblástica e estimular a formação óssea. O objetivo deste estudo foi avaliar a biocompatibilidade e a osteocondução em defeitos cirúrgicos preenchidos com microesferas de nano-hidroxiapatita contendo estrôncio a 1% (nano-SrHA), microesferas de nano-HA estequiométrica (nano-HA) em comparação ao coágulo (controle). Quatro ovelhas Santa Inês, pesando em média 32 kg, foram anestesiadas e submetidas a três perfurações de 2 mm de diâmetro na face medial da tíbia. Os defeitos cirúrgicos foram preenchidos com coágulo sanguíneo, microesferas de Sr-HA 1% e microesferas de HA. Após 30 dias as amostras foram trefinadas (6 mm), descalcificadas, processadas para inclusão em parafina e coradas com hematoxilina e eosina (HE) para avaliação histológica com microscopia de luz. Todos os grupos revelaram neoformação óssea da periferia para o centro do defeito, sendo o grupo nano-SrHA com menor intensidade dentre os estudados. Presença de discreto infiltrado inflamatório mononuclear em todos os grupos experimentais. Células gigantes do tipo corpo estranho só foram observadas no grupo da HA. Áreas de neoformação óssea foram observadas em íntimo contato com ambos os biomateriais. De acordo com os resultados obtidos, microesferas de HA e SrHA 1% são biocompatíveis e apresentam propriedade de osteocondução.
Palavras-chave: Estrôncio. Durapatita. Ovinos.
ABSTRACT
With the advances on biomaterials research have suggested that the best osteoconductivity of hydroxyapatite could be achieved if the crystal was closer to the structure, size and morphology of biological apatite, so the nano-hydroxyapatite (nano-HA) is of current interest. Strontium ions are known to reduce bone resorption, induce osteoblastic activity and thus stimulate bone formation. The aim of this study was to evaluate the biocompatibility and osteoconductive in surgical defects filled with spheres of nano-hydroxyapatite containing strontium 1% (nano-SrHA), nano-hydroxyapatite stoichiometric (nano-HA) when compared to the blood clot (control). Four Santa Inês sheeps, weighing on average 32 kg were anesthetized and subjected to three perforation 2 mm in diameter on the medial site of tibia. The surgical defects were filled with blood clot, Sr-HA 1% microspheres and HA microspheres. After 30 days the samples were trephyned (6 mm), decalcified, processed for embedding in paraffin and stained with hematoxilin and eosin (HE) for histological evaluation with light microscopy. All groups showed new bone formation from the periphery to the center of the defects, and the group nano-Sr with a lesser extent among those studied. The mononuclear inflammatory infiltrate remained mild in all experimental groups. The presence of giant cells type foreign body was detected only in the HA group. Areas of bone formation were detected in close contact with biomaterials. According to the results spheres containing nano-SrHA 1% and nano-HA can be considered as biocompatible and with osteoconductive properties.
Key words: Strontium. Durapatite. Sheep.
INTRODUÇÃO
Defeitos ósseos localizados podem ocorrer como resultado de infecções, processos patológicos, lesões congênitas, lesões traumáticas ou mesmo em decorrência de exodontias e geralmente interferem na instalação de implantes e reabilitação protética. Nos últimos anos, com o objetivo de restaurar e preservar a morfologia do osso alveolar, novos materiais e técnicas têm sido alvo de pesquisas visando proporcionar o desenvolvimento de um conjunto de procedimentos e biomateriais que otimizem a realização desta reabilitação10,12.
Os enxertos ósseos são classificados de acordo com a sua origem, como autógenos, alógenos, xenógenos e sintéticos ou aloplásticos. As limitações e dificuldades existentes para a obtenção de enxertos ósseos autógenos, como desconforto pós-operatório do paciente, morbidade do sítio doador, limitação da quantidade de enxerto, questões éticas, religiosas e a possibilidade de transmissão de doenças dos enxertos alógenos e xenógenos mantém estimulados os pesquisadores a desenvolverem biomateriais sintéticos, para auxiliar na regeneração do tecido ósseo perdido24.
Os fosfatos de cálcio têm sido estudados como materiais utilizados no reparo ósseo nos últimos 80 anos. Dos compostos à base de fosfato de cálcio, os mais extensamente investigados são a hidroxiapatita (HA) e o tricalcio-fosfato. A HA tem sido amplamente utilizada como um importante substituto ósseo e se distingue das demais cerâmicas à base de fosfato de cálcio por ser similar à porção inorgânica do tecido ósseo, biocompatível, resistente mecanicamente, bioativa, não tóxica, radiopaca, permitindo o acompanhamento periódico através de exames de imagem, provocar pouca reação tecidual e não ser antigênica e nem carcinogênica, além de apresentar uma grande capacidade de adsorção de proteínas em sua superfície15. A HA sintética geralmente empregada é em forma de partículas grossas, que têm o tamanho e forma do cristal bastante diferente da morfologia das apatitas biológicas do osso18. Tem sido sugerido que a melhor osteocondutividade da HA seria alcançada se o seu cristal estivesse mais perto da estrutura, tamanho e morfologia da apatita biológica8,16,19. A alta estabilidade e flexibilidade desta estrutura de apatita, permite a grande variedade de possíveis substituições catiônicas e aniônicas, tendo assim a presença de um número de íons estrangeiros associados à apatitas biológicas18. O estrôncio (Sr) está presente na fase mineral dos ossos, especialmente nas regiões de maior função metabólica2; seu conteúdo no novo osso compacto é de três a quatro vezes superior ao de um osso velho compacto, e aproximadamente, 2,5 vezes maior no osso novo esponjoso que no mais antigo11. Por aumentar a atividade dos osteoblastos e diminuir a atividade dos osteoclastos o Sr apresenta um efeito anti-reabsortivo e formador de osso in vitro3. Cerâmicas de fosfato de cálcio contendo Sr mostraram aumentar a proliferação e diferenciação de osteoblastos in vitro23. Um estudo prévio revelou in vivo um aumento na espessura da camada óssea formada na interface osso-cimento e uma melhor osseointegração do cimento SrHA, em comparação com o cimento HA puro20. O objetivo deste estudo foi de realizar uma avaliação histológica subjetiva do reparo ósseo em tíbias de ovelhas 30 dias após a implantação de microesferas de nano-hidroxiapatita (nano-HA) e nano-HA contendo estrôncio a 1 % (nano-SrHA) em comparação ao coágulo (controle).
MATERIAL E MÉTODOS
Foram utilizadas nessa pesquisa 4 ovelhas da raça Santa Inês, de ambos os gêneros pesando entre 30 e 55 kg e privadas de alimentação 24 horas antes do procedimento cirúrgico. Os animais foram previamente pesados e operados sob anestesia geral, e, receberam como medicação pré-anestésica acepromazina (0,1 mg.kg-1) IV, diazepam (0,2 mg.kg-1) IV e morfina (0,4 mg.kg-1) IM. A indução foi realizada com propofol (4 mg.kg-1) IV e diazepam (0,1 mg.kg-1) IV (dose efeito),e a manutenção anestésica com isoflurano na concentração adequada para que não ocorressem respostas autonômicas.
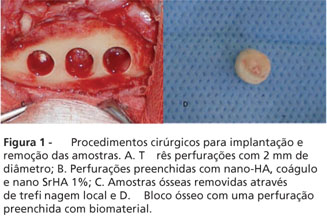
Após a realização da tricotomia e degermação na face medial da tíbia, os animais foram instalados na mesa operatória em decúbito lateral. Em seguida, uma incisão de aproximadamente 6 cm foi realizada para permitir o descolamento até a exposição do plano esquelético para a realização de três perfurações distando de 6-8 cm da crista tibial com 2 mm de diâmetro (fresas lança e esférica de 2 mm/ SIN - Sistema de Implante, São Paulo, SP, Brasil) (Figura 1A). Os defeitos ósseos foram preenchidos com microesferas de nano-HA, coágulo e microsferas de nano-SrHA (Figura 1B). Os planos interno e externo foram suturados com fio Vycril 3,0 e fio de Nylon 5,0, respectivamente. A ferida operatória foi deixada descoberta e todos os animais receberam como protocolo pós-operatório para evitar infecções e controle de dor meloxicam na dose de 0,5 mg.kg-1 durante cinco dias e antibiótico enrofloxacina 5 mg.kg-1, antes da cirurgia e durante cinco dias após todos os procedimentos cirúrgicos.
Decorrido o período experimental de 30 dias, os animais foram anestesiados, como descrito anteriormente, e foram executados: incisão, descolamento, remoção das amostras com fresa trefina de 6 mm de diâmetro interno (Figura 1C e 1D) seguida sutura por planos. Os animais foram mantidos vivos e o protocolo de sutura e pós-operatório adotado foi o mesmo do tempo cirúrgico anterior.
As amostras obtidas dos 4 animais foram fixadas durante 48 horas em formol 10% tamponado com pH 7,4, lavadas em água corrente por 6 horas, desmineralizadas com o descalcificador de ossos Allkimia® em temperatura ambiente, durante 48 horas. Após a desmineralização dos blocos, estes foram desidratados, diafanizados e incluídos em parafina. Cortes transversais com espessura de 5 µm e corados com hematoxilina e eosina (HE) foram obtidos e analisados em microscopia de luz. Na análise microscópica foi avaliado tipo e intensidade do processo inflamatório em resposta ao procedimento, presença de tecido conjuntivo e osso neoformado no defeito cirúrgico descritos através de análise subjetiva.
RESULTADOS
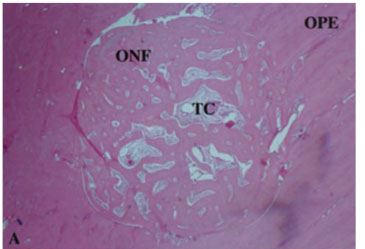
A análise histológica revelou que no grupo contendo coágulo (controle) foi observado neoformação óssea da periferia para o centro do defeito ósseo, composta por largas trabéculas ósseas anastomosadas, porém na porção central do defeito observou-se áreas de tecido conjuntivo frouxo e raras células inflamatórias (Figura 2A).
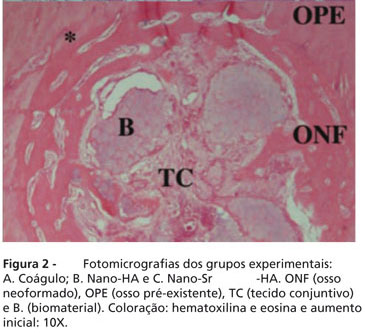
No grupo nano-HA foi observada a neoformação óssea da periferia em direção ao centro do defeito, presença de trabéculas ósseas neoformadas com pavimentação osteoblástica, porção central do defeito composta por tecido conjuntivo frouxo com presença de biomaterial, escasso infiltrado inflamatório crônico e poucas células gigantes multinucleadas (Figura 2B).
O grupo nano-SrHA exibiu neoformação óssea da periferia para o centro, presença de tecido conjuntivo frouxo na porção central do defeito, além de escasso infiltrado inflamatório predominantemente linfoplasmocitário. Observou-se grande quantidade de biomaterial e na sua periferia matriz óssea (Figura 2C).
Em nenhum dos grupos foram observadas áreas de necrose. Nos dois grupos implantados observou-se íntimo contato de osso na interface com os biomateriais.
DISCUSSÃO
O aspecto mais importante durante o desenvolvimento de novos biomateriais é o ensaio experimental e clínico para avaliar sua biocompatibilidade17. O uso de ovinos para a pesquisa tem aumentado ao longo do tempo devido às semelhanças com os seres humanos em peso, estrutura óssea e articular, e, regeneração óssea1,13. Foi observado neste estudo que o modelo de perfuração em ovinos prova ser um excelente modelo animal para avaliar a biocompatibilidade de biomateriais substitutos ósseos, onde no modelo de implantação (fêmur), revelou a possibilidade de implantação de até 8 biomateriais por animal14 e também pela possibilidade de manutenção dos animais vivos após o término do experimento.
A nano-HA é de interesse atual devido as suas propriedades biológicas comparada com HA, além da sua maior semelhança com a apatita fisiológica8. Estudos prévios mostraram o aumento da motilidade dos osteoblastos expostos a partículas de nano-HA esféricas25 e o aumento na migração destas células quando expostos a partículas esféricas nano-HA9. A nano-HA exibe excelente adesão, não só para os tecidos mineralizados como aos não mineralizados22. Baseado nesses estudos anteriores, o presente estudo adotou como formato do material esferas.
O presente estudo demonstrou que a HA contendo Sr a 1% é biocompatível, apresentando osso neoformado em íntimo contato com o biomaterial, porém revelou menos intensidade de neoformação óssea que a nano-HA, resultados estes não confirmados por um prévio estudo que avaliou um cimento de HA contendo Sr, que apresentou melhor osteocondutividade, biocompatibilidade e biodegradabilidade do que o cimento de HA livre de Sr. Além disso, as doses de Sr incorporadas na estrutura do cristal da HA desempenharam um papel ativo in vitro e in vivo. A partir dos dados dos testes de biocompatibilidade, observaram que o cimento contendo Sr a 5% foi mais biocompatível, seguido do cimento de HA contendo Sr a 10% e por último o cimento de HA livre de Sr6. Em outro estudo, desses mesmos autores, apurou-se também que o cimento de HA contendo Sr a 5% atingiu maior resistência a compressão das amostras analisadas (5-10%)7. Estes dados indicam que existe uma dose ideal de Sr a incorporar no cristal da HA a fim de obter melhores propriedades físico-químicas e de biocompatibilidade5. No entanto, os resultados do implante intramuscular e das experiências de implantação no fêmur de coelhos mostram que a taxa de dissolução média do cimento de HA contendo Sr aumenta com a elevação da dose de Sr6. Isso pode ser explicado pelo fato de que uma HA contendo substituições é considerada uma HA deficiente em cálcio e, consequentemente, mais solúvel e quanto maior for a incorporação do metal mais deficiente em cálcio ela se torna, por isso a concentração do metal incorporado é um importante parâmetro de controle para ajustar as propriedades da HA.
Um estudo in vitro avaliou a bioatividade da HA contendo Sr em fluido corporal simulado, e seu efeito sobre a proliferação, morfologia celular, fosfatase alcalina e atividade de osteopontina na cultura de células osteoprecursoras in vitro. A cerâmica de HA contendo Sr exibiu alta bioatividade em líquido corporal simulado, que foi clara pela formação rápida de apatita em sua superfície. O teste de cultura celular indicou que a HA contendo Sr tem boa biocompatibilidade em osteoblastos humanos. Comparado com HA, a Sr-HA promoveu adesão de células osteoprecursoras e proliferação celular, e não apresentou nenhum efeito deletério sobre a formação da matriz extracelular e mineralização. Também foi demonstrado que a presença do Sr estimula a diferenciação de células osteoprecursoras, e aumenta a fosfatase alcalina e expressão da osteopontina23. Esse estudo concluiu que o Sr promove a ação osteoblástica e neoformação óssea subsequente. Esses resultados diferentes dos obtidos podem ser justificados pela concentração do Sr utilizado nesse estudo (1%). Porém mais pesquisas são necessárias para a compreensão detalhada dos mecanismos celulares e moleculares dos efeitos do estrôncio em células ósseas.
Outro estudo in vitro realizado com o intuito de avaliar a resposta osteoblástica e osteoclástica da HA contendo Sr em diferentes concentrações, mostrou que células osteoblásticas cultivadas em HA, contendo Sr cresceram exibindo morfologia normal, boa proliferação e aumento de valores dos parâmetros de diferenciação, ao mesmo tempo, o número de osteoclastos foi influenciado negativamente pela presença do Sr. O efeito positivo do íon nas células ósseas foi particularmente evidente no caso de deposição de HA contendo Sr relativamente elevada (3-7%), valores que aumentaram significativamente a atividade da fosfatase alcalina, osteocalcina, colágeno tipo I e osteoprotegerina/TNF relacionada a receptores de citocinas, também foi observada a redução considerável de proliferação de osteoclastos4.
Um estudo in vivo investigou a resposta tecidual óssea de um cimento ósseo de HA contendo Sr injetado em osso esponjoso de crista ilíaca de coelhos por 1, 3 e 6 meses. A afinidade óssea ao cimento de HA contendo Sr aumentou de 73,55% ± 3,50% após 3 meses para 85,15% ± 2,74% após 6 meses (p = 0.01)21. Esses resultados evidenciam que o cimento de HA contendo Sr é biocompatível e osteocondutor, confirmando os dados obtidos neste estudo apesar do nosso período experimental ter sido de apenas 30 dias. Em outro estudo in vivo, foi alcançada a osseointegração em osso esponjoso com o uso de cimento de HA contendo Sr em coelhos, que estimulou a formação e união óssea, a fusão do osso com cimento de HA contendo Sr e indicou biocompatibilidade in vivo. A marcação com tetraciclina mostrou que a área de mineralização foi na ordem: 3 meses - 1 mês - 6 meses. No 1º mês, o aumento da mineralização foi devido ao processo de cicatrização do osso. Um aumento adicional na área de mineralização em 3 meses indicou que a HA contendo Sr tem um efeito estimulante na formação óssea. A área de mineralização diminuiu em 6 meses porque o processo de cicatrização foi concluído apresentando remodelação óssea20. Dentre todos os estudos analisados foi observado que a HA contendo Sr é biocompatível em dependência da concentração de Sr e do período do experimento.
CONCLUSÃO
De acordo com os resultados obtidos as microesferas de HA e SrHA 1% podem ser consideradas biocompatíveis e com potencial osteocondutor podendo ser indicadas como substitutos ósseos.
REFERÊNCIAS
1. Augat P, Margevicius K, Simon J, Wolf S, Suger G, Claes L. Local tissue properties in bone healing: influence of size and stability of the osteotomy gap. J Orthop Res. 1998;16(4):475-81. [ Links ]
2. Blake GM, Zivanovic MA, McEwan AJ, Ackery DM. Sr-89 therapy: strontium kinetics in disseminated carcinoma of the prostate. Eur J Nucl Med. 1986;12(9):447–54. [ Links ]
3. Canalis E, Hott M, Deloffre P, Tsouderos Y, Marie PJ. The divalent strontium salt S12911 enhances bone cell replication and bone formation in vitro. Bone. 1996;18(6):517–23. [ Links ]
4. Capuccini C, Torricelli P, Sima F, Boanini E, Ristoscu C, Bracci B, et al. Strontium-substituted hydroxyapatite coatings synthesized by pulsed-laser deposition: in vitro osteoblast and osteoclast response. Acta Biomater. 2008;4(6);1885-93. [ Links ]
5. Christoffersen J, Christoffersen MR, Kolthoff N, Bärenholdt O. Effects of strontium ions on growth and dissolution of hydroxtapatite and on bone mineral detection. Bone. 1997;20(1):47-54. [ Links ]
6. Dagang G, Kewei X, Yong H. The influence of Sr doses on the in vitro biocompatibility and in vivo degradability of single-phase Sr-incorporated HAP cement. J Biomed Mater Res A. 2008;86(4):947-58. [ Links ]
7. Guo D, Xu K, Zhao X, Han Y. Development of a strontium-containing hydroxyapatite bone cement. Biomaterials. 2005;26(19):4073-83. [ Links ]
8. Hu R, Lin CJ, Shi HY. A novel ordered nano hydroxyapatite coating electrochemically deposited on titanium substrate. J Biomed Mater Res A. 2007;80(3):687-92. [ Links ]
9. Huang Z, Tian J, Yu B, Xu Y, Feng Q. A bone-like nano-hydroxyapatite/collagen loaded injectable scaffold. Biomed Mater. 2009;4(5):055005. [ Links ]
10. Lekovic V, Kenney EB, Weinlaender M, Han T, Klokkevold P, Nedic M, et al. A bone regenerative approach to alveolar ridge maintenance following tooth extraction. Report of 10 cases. J Periodontol. 1997;68(6):563-70. [ Links ]
11. Marie PJ, Ammann P, Boivin G, Rey C. Mechanisms of action and therapeutic potential of strontium in bone. Calcif Tissue Int. 2001;69(3):121-9. [ Links ]
12. Melloning JT, Triplett RG. Guided tissue regeneration and endosseous dental implants. Int J Periodontics Restorative Dent. 1993;13(2):109-19. [ Links ]
13. Nunamaker DM. Experimental models of fracture repair. J Clin Orthop Relat Res. 1989;(355 Suppl):56-65. [ Links ]
14. Nuss KMR, Auer JA, Boss A, von-Rechenberg B. An animal model in sheep for biocompatibility testing of biomaterials in cancellous bones. BMC Musculoskeletal Disord. 2006;7:67. [ Links ]
15. Patel N, Brooks RA, Clarke MT, Lee PM, Rushton N, Gibson IR, et al. in vivo assessment of hydroxyapatite and silicate-substituted hydroxyapatite granules using an ovine defect model. J Mater Sci Mater Med. 2005;16(5):429-40. [ Links ]
16. Pezzatini S, Solito R, Morbidelli L, Lamponi S, Boanini E, Bigi A, et al. The effect of hydroxyapatite nanocrystals on microvascular endothelial cell viability and functions. J Biomed Mater Res A. 2006;76(3):656-63. [ Links ]
17. Ratner BD. New ideas in biomaterials science -- a path to engineered biomaterials. J Biomed Mat Res. 1993;27(7);837-50. [ Links ]
18. Suchanek W, Yoshimura M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J Mater Res. 1998;13(1):94-117. [ Links ]
19. Tadic D, Beckmann F, Schwarz K, Epple M. A novel method to produce hydroxyapatite objects with interconnecting porosity that avoids sintering. Biomaterials. 2004;25(16):3335-40. [ Links ]
20. Wong CT, Chen QZ, Lu WW, Leong JC, Chan WK, Cheung KMC, et al. Ultrastructure study of mineralization of a strontium-containing hydroxyapatite (Sr-HA) cement in vivo. J Biomed Mater Res A. 2004;70(3):428-35. [ Links ]
21. Wong CT, Lu WW, Chan WK, Cheung KMC, Luk KDK, Lu DS, et al. in vivo cancellous bone remodeling on a Strontium containing hydroxyapatite (Sr-HA) bioactive cement. J. Biomed Mater Res A. 2004;68(3):513-21. [ Links ]
22. Xu JL, Khor KA, Sui JJ, Zhang JH, Chen WN. Protein expression profiles in osteoblasts in response to differentially shaped hydroxyapatite nanoparticles. Biomaterials. 2009;30(29):5385-91. [ Links ]
23. Xue W, Moore JL, Hosick HL, Bose S, Bandyopadhyay A, Lu WW, et al. Osteoprecursor cell response to strontium-containing hydroxyapatite ceramics. J Biomed Mater Res A. 2006;79(4):804-14. [ Links ]
24. Yamamoto MK, Luz JGC, Araujo VC. Resposta tecidual óssea frente à hidroxiapatita granular implantada em defeitos criados na mandíbula de ratos. Rev Odontol Univ São Paulo. 1994;8(4):281-6. [ Links ]
25. Zhang R, Zhou L, Li Q, Liu J, Yao W, Wan H. Upregulation of two actin- associated proteins prompts pulmonary artery smooth muscle cell migration under hypoxia. Am J Respir Cell Mol Biol. 2009;41(4):467-75. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Mônica Diuana Calasans Maia
Rua São Paulo, 28 - Valonguinho Centro
24040-110 - Niterói - Rio de Janeiro - Brasil
E-mail: monicacalasansmaia@gmail.com
Recebido: 19/02/2010
Aceito: 23/03/2010