Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Innovations Implant Journal
versão On-line ISSN 1984-5960
Innov. Implant. J., Biomater. Esthet. (Online) vol.5 no.2 São Paulo Mai./Ago. 2010
ARTIGOS CIENTÍFICOS
Aderência de microrganismos em implantes dentários de superfície lisa ou tratada
Adhesion of microorganisms in dental implants with a smooth surface or treated
Rogério de Lima RomeiroI; Cristiane PereiraII; Aline Vieira da SilvaIII; Leandro Aires BertrameloIV; Antonio Olavo Cardoso JorgeV
IDoutor em Biopatologia Bucal. Professor Responsável pela Disciplina de Implantodontia, Faculdade de Pindamonhangaba, Pindamonhangaba, SP, Brasil
IIDoutoranda em Microbiologia e Imunologia, Faculdade de Odontologia de São José dos Campos, Universidade Estadual Paulista, São José dos Campos, SP, Brasil
IIICirurgiã-dentista
IVCirurgião-dentista
VProfessor Titular da Disciplina de Microbiologia e Imunologia, Faculdade de Odontologia de São José dos Campos, Universidade Estadual Paulista, São José dos Campos, SP, Brasil
RESUMO
O objetivo desse trabalho foi analisar in vitro a aderência de Streptococcus sanguinis às superfícies dos implantes dentários tratados com jateamento de fosfato de cálcio, anodização, duplo ataque ácido e os de superfície lisa. Foram selecionados 40 implantes, sendo 10 de cada superfície. Para análise da aderência, foram preparadas suspensões do microrganismo contendo 106 células/ml em espectrofotômetro. O implante foi removido da embalagem e colocado diretamente no caldo. Em seguida, foram acondicionados separadamente em poços de placas de cultura de células contendo caldo sacarosado (placa in vitro) e a suspensão do microrganismo. Após 24h de incubação a 37 ºC e 5% de CO2, os implantes foram lavados três vezes durante um minuto em solução salina estéril e colocados em sonicador com 10 ml de salina para dispersão das células aderidas. A seguir, foram realizadas diluições seriadas e semeaduras em meios de cultura específico para cada microrganismo. Após 48h de incubação a 37 ºC e 5% de CO2, foi realizada a contagem de unidades formadoras de colônias (UFC/ml) e os dados foram submetidos à análise de variância (ANOVA), teste de Tukey, com nível de significância de 5%. Os resultados demonstraram uma grande aderência dos microrganismos às superfícies estudadas. A superfície anodizada apresentou os menores valores de aderência dos dois microrganismos, já a superfície submetida ao duplo ataque ácido apresentou maiores valores de UFC/ml.
Palavras-chave: Implantes dentários. Streptococcus sanguis. Periodontia.
ABSTRACT
The aim of this study was to analyze in vitro the adherence of Streptococcus sanguinis to dental implant surfaces treated with calcium phosphate blasting, anodizing, double acid etching and smooth surface. We selected 40 implants, 10 in each area. For analysis of adhesion of microorganism suspensions were prepared containing 106 cells/ml in a spectrophotometer. The implant was removed from its packaging and placed directly in the broth. Then were placed separately in of culture plates of cells containing broth containing sucrose (plate in vitro) and suspension of the microorganism. After 24h incubation at 37 oC and 5% CO2, the implants were washed three times for one minute in sterile saline and placed in a sonicator with 10 ml of saline for dispersion of the adhered cells. Next, serial dilutions were performed sowing and in culture media specific for each microorganism. After 48 h incubation at 37 oC and 5% CO2, were the count of colony forming units (CFU/ml) and the data were subjected to analysis of variance (ANOVA), Tukey test, with significance level 5%. The results showed a high adherence of microorganisms to surfaces studied. The anodized surface had the lowest values of adherence of two microorganisms, since the surface subjected to the double acid etching presented higher values of CFU/ml.
Key words: Dental implants. Streptococcus sanguis. Periodontics.
INTRODUÇÃO
A cavidade bucal humana é do ponto de vista ecológico, um sistema de crescimento aberto, ocorrendo transporte contínuo de microrganismos. Para sobreviver na cavidade bucal e causar infecção, os microrganismos precisam aderir-se às superfícies, ou então serão removidos pelo fluxo salivar. A boca apresenta condições ideais de crescimento para diversos microrganismos, possuindo muitos nichos que podem ser colonizados12,17.
A aderência de microrganismos às superfícies bucais rígidas como o esmalte dentário, material restaurador ou implante, é um pré-requisito para a formação do biofilme, que pode, eventualmente, ocasionar cárie, doença periodontal ou periimplantite. A colonização bacteriana nas superfícies dentárias é sempre precedida pela aderência da película adquirida formada pela saliva ou fluido gengival. A composição do biofilme maduro é dependente de uma aderência primária entre bactérias pioneiras e película adquirida9-10,13,24.
Vários estudos têm demonstrado que tanto a qualidade quanto a quantidade do biofilme aderido são importantes no sucesso em longo prazo dos implantes dentais. A aderência inicial e a colonização de bactérias na superfície do implante são consideradas as chaves da patogênese das infecções causadas pelas bactérias do biofilme11,14-15,18.
Atualmente trabalha-se em busca de uma superfície de implante ideal que permita perda mínima de tecido ósseo da crista marginal do implante. Sabe-se que um implante em condições adequadas, quando em função perde de 1 a 1,5 mm de crista óssea no primeiro ano e 0,2 mm por ano nos anos subsequentes1. Não se tem levado em consideração, entretanto, a maior susceptibilidade dessas superfícies em promover aderência bacteriana, facilitando a formação do biofilme dentário.
O objetivo do presente trabalho foi avaliar, in vitro, a aderência de S. sanguinis, microrganismo da comunidade pioneira, nos implantes de superfície lisa e tratada com duplo ataque ácido, anodização e jateamento com fosfato de cálcio.
MATERIAL E MÉTODOS
Para realização do experimento foram selecionados 40 implantes de titânio comercialmente puro:
- 10 implantes de superfície lisa (ACE®, Brockton, MA, Estados Unidos) medindo 3,3 mm de diâmetro por 10 mm de comprimento, de hexágono externo com os tapa-implantes instalados;
- 10 implantes de superfície submetida ao duplo ataque ácido (Osseotite, 3i®, Palm Beach Gardens, FL, Estados Unidos) de 3,25 mm de diâmetro por 10 mm de comprimento, também de hexágono externo com os tapa-implantes instalados;
- 10 implantes de superfície anodizada (TiUnite, NOBEL BIOCARE®, Gotemburgo, Suécia) medindo 3,3 mm de diâmetro por 10 mm de comprimento, de hexágono externo com os tapa-implantes instalados;
- 10 implantes de superfície jateada com cerâmica de fosfato de cálcio (RBM - Resorbable Blast Media, - ACE®, Brockton, MA, Estados Unidos) medindo 3,3 mm de diâmetro por 10 mm de comprimento, de hexágono externo com os tapa-implantes instalados.
Foi utilizada amostra padrão de S. sanguinis (ATCC10556). Os implantes foram, imediatamente depois de removidos da embalagem estéril, transferidos assepticamente para poços de placas de cultura de células (Costar®, Uberlândia, Brasil).
O microrganismo foi semeado em placas de Petri contendo ágar BHI (Brain Hert Infusion) e incubados a 37 ºC e 5% de CO2 por 48 horas. A partir do crescimento, foi preparada suspensão padronizada do microrganismo contendo 106 células/ml, por análise em espectrofotometria (Espectrofotômetro B-582 - Micronal 3.0.4 -São Paulo, SP, Brasil).
Os implantes foram colocados individualmente em poços de placas de cultura de células (Costar® - Uberlândia, MG, Brasil) contendo 2,0 ml de caldo para placa in vitro6 e 0,1 ml da suspensão padronizada com o microrganismo. As placas de cultura de células foram tampadas e incubadas a 37 ºC por 24 h a 5% de CO2, em incubadora de CO2. A seguir, os implantes foram removidos e lavados durante um minuto, por três vezes, em solução fisiológica esterilizada para retirada das células bacterianas não aderidas e transferidos para tubos Falcon, contendo 10 ml de solução fisiológica (NaCl 0,85%) esterilizada e submetidos ao homogeneizador ultrassônico (Sonicador Bandelin Sonoplus), utilizando-se potência de 50 W por 30 segundos para retirar as células microbianas aderidas. A suspensão inicial obtida foi diluída 100 e 1000 vezes e uma alíquota de 0,1 ml foi transferida, em duplicata, para placas contendo ágar BHI.
Após 48 horas de incubação a 37 ºC com 5% de CO2, o número de unidades formadoras de colônias (UFC/ml) foi determinadopara cada implante. As placas escolhidas para contagem foram aquelas que apresentaram entre 30 e 300 UFC/ml (Figura 1).
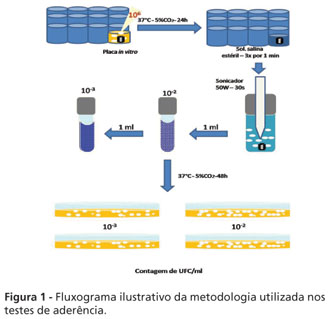
A contagem de colônias foi realizada em aparelho contador de colônias (Phoenix Luferco CP-600, Araraquara, SP, Brasil).
ANÁLISE EM MICROSCOPIA ELETRÔNICA DE VARREDURA
Para ilustrar a aderência foi selecionado um implante de cada superfície para ser submetido à análise em microscopia eletrônica de varredura.
Após a incubação dos implantes em caldo placa in vitro contendo suspensão padronizada do microrganismo a 37º C, 5% de CO2 por 24 horas, os implantes foram removidos do caldo e foi realizada a fixação do microrganismo aderido na superfície dos implantes. Para essa fixação, os implantes foram submersos em glutaraldeído 2,5% por 1 hora e em seguida, em solução alcoólica a 10%, 25%, 50%, 75% e 90% por vinte minutos em cada. Finalmente por uma hora em álcool a 100%.
Com o microrganismo fixado à superfície dos implantes, foi realizada a metalização com plasma de ouro (metalizadora Denton Vacuum, Moorestown, NJ, Estados Unidos). Posteriormente, a aderência do microrganismo foi visualizada no microscópio eletrônico de varredura (Jeol - JSM5310, Tokyo, Japão) do Instituto Nacional de Pesquisas Espaciais (São José dos Campos - SP, Brasil) em aumento de 5000 vezes.
ANÁLISE ESTATÍSTICA
Para a análise estatística, os resultados obtidos foram convertidos em logarítimo de 10 e submetidos à análise de variância (ANOVA), teste de Tukey, com nível de significância de 5%.
RESULTADOS
As médias e desvios padrões (log UFC/ml) da aderência são apresentados na Tabela 1.

A diferença na quantidade de S. sanguinis aderido às diversas superfícies do estudo foi relativamente pequena, mas estatisticamente significante.
Os implantes submetidos ao tratamento com duplo ataque ácido e os de superfície lisa demonstraram maior concentração de microrganismos aderidos. Já os implantes submetidos ao tratamento por anodização apresentaram menor aderência entre as superfícies estudadas, apresentando-se estatisticamente menor.
ADERÊNCIA EM MICROSCOPIA ELETRÔNICA DE VARREDURA
Inicialmente foram realizadas micrografias das superfícies dos implantes previamente à incubação dos microrganismos (Figura 2).

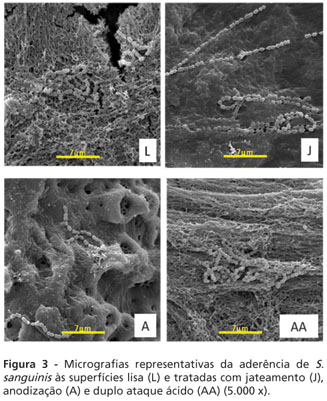
Após a avaliação dos dados em UFC/ml e a análise estatística, foi realizada formação de biofilme de S. sanguinis nas superfícies estudadas, os quais foram visualizados em microscopia eletrônica de varredura, com o intuito de ilustrar o experimento (Figura 3).
DISCUSSÃO
Estudos demonstraram que a peri-implantite possui uma patogênese semelhante ao da doença periodontal16,18-19. A correlação entre acúmulo de biofilme, presença de periodontopatógenos e nível de perda óssea ao redor do tecido peri-implantar já foi comprovada4,9,19-20.
Em pacientes edêntulos, a área subgengival ao redor dos implantes apresenta principalmente cocos Gram-positivos anaeróbios facultativos e bastonetes não móveis. Em peri-implantes saudáveis, Streptococcus sanguinis e Streptococcus mitis são os microrganismos predominantes. A microbiota peri-implantar em pacientes edêntulos é comparada à microbiota que coloniza tecidos moles de pacientes edêntulos sem implantes e a subgengival de pacientes periodontalmente sadios9,20,22.
A formação inicial do biofilme pode ser influenciada por diferentes superfícies de implantes21,23. A aderência de microrganismos a implantes dentários parece ser diretamente proporcional à rugosidade de sua superfície. Um estudo in vivo expondo diferentes materiais de implantes à microbiota bucal demonstrou que estreptococos foram os microrganismos predominantes no biofilme e que a quantidade e qualidade do biofilme formado foram relacionadas aos tipos de superfícies dos implantes14.
A aderência e colonização bacteriana foram consideradas fatores chaves no insucesso dos implantes dentários21.A peri-implantite não ocorre sem prévia aderência microbiana e subsequente colonização. A aderência depende do tipo de microrganismo e das propriedades físico-químicas da superfície do implante5.
Assim, torna-se necessário estudar a influência das superfícies dos implantes sobre a aderência microbiana e consequente formação de biofilme dentário.
Analisando as diferenças de aderência nas diversas superfícies, este estudo demonstrou maior aderência de S. sanguinis aos implantes tratados por condicionamento com duplo ataque ácido e liso e uma menor aderência aos implantes de superfície anodizada, ficando os jateados com cerâmica de fosfato de cálcio em um nível intermediário de aderência. Este resultado demonstrou que nem sempre a superfície lisa apresenta menor aderência de microrganismos. A formação de biofilme dentário foi analisada in vitro sobre a superfície de implantes lisos e tratados com deposição física de vapor, nitrato de titânio e nitrato de zircônia7. Uma significante diminuição na aderência de S. sanguinis foi verificada nas três superfícies tratadas quando comparadas com a superfície lisa. Analisando in vivo a formação de biofilme sobre essas mesmas superfícies foi comprovada maior aderência a implantes lisos8. A análise da aderência de S. sanguinis em implantes lisos, rugosos e com ranhuras, demonstrou menor aderência em implantes de superfície lisa, porém esta análise foi realizada em microscopia eletrônica de varredura25.
A energia livre de superfície é diretamente proporcional à hidrofilia da superfície e como a maioria dos microrganismos são hidrofílicos, uma aproximação a uma superfície hidrofílica é termodinamicamente desfavorável2. Em trabalho sobre a avaliação da energia livre de superfície de implantes submetidos a tratamento de superfície com anodização e duplo ataque ácido comparando a implantes lisos, verificou-se uma maior energia de superfície de implantes submetidos à anodização quando comparados às outras duas superfícies, que não apresentaram diferença estatística entre si3. Portanto, a hidrofilia da superfície anodizada pode explicar a menor aderência de microrganismo nesta superfície encontrada no presente trabalho.
Os fabricantes de implantes dentários desenvolveram tratamentos de superfícies com o intuito de aumentar a rugosidade dos implantes e, consequentemente, melhorar o contato com o osso durante a osseointegração. Dessa forma cada empresa apresenta uma superfície com tratamento peculiar. Sem análises específicas sobre a aderência de microrganismos a essas superfícies, algumas empresas nacionais e internacionais, prevendo uma menor aderência em superfícies lisas, mantêm as primeiras roscas do implante sem tratamento. Após análises dos dados deste estudo e dos encontrados na literatura, parece claro que o método como é feito esse tratamento influencia, não só no potencial de osseointegração, mas também na aderência de microrganismos, que ocorrerá quando este implante estiver exposto ao meio bucal. Desta forma, na utilização clínica de implantes deve-se levar em conta não apenas estudos que mostram sua capacidade de osseointegração, mas também sua suscetibilidade à aderência de microrganismo, principalmente os pioneiros na formação do biofilme que servirão de alicerce para a colonização de microrganismos patogênicos ao tecido peri-implantar.
CONCLUSÃO
A partir da metodologia empregada, os resultados permitem concluir que a aderência de S. sanguinis à superfície anodizada foi inferior quando comparadas às superfícies condicionadas com duplo ataque ácido e liso, que apresentaram maior aderência.
REFERÊNCIAS
1. Albrektsson T, Zarb G, Worthington P, Eriksson AR. The long-term efficacy of curretly used dental implants: a review and proposed criteria of success. Int J Oral Maxillofac Implants. 1986;1(1):11-25. [ Links ]
2. Chamberlain AHL.The role of adsorbed layers in bacterial adhesion. In: Melo LF, Bott TR, Fletcher B, Capdeville B, editors. Biofilmsscience and technology. Dordrecht: Kluwer; 1992. p. 59-67. [ Links ]
3. Coutinho MP. Influência da morfologia da superfície na molhabilidade do titânio comercialmente puro [dissertation]. Rio de Janeiro: Instituto Militar de Engenharia; 2007. [ Links ]
4. Fürst MM, Salvi GE, Lang NP, Persson GR. Bacterial colonization immediately after installation on oral titanium implants. Clin Oral Implants Res. 2007 Aug;18(4):501-8. [ Links ]
5. Gatewood RR, Cobb CM, Killoy WJ. Microbial colonization on natural tooth structure compared with smooth and plasma-sprayed dental implants surface. Clin Oral Implants Res. 1993;4(2):53-64. [ Links ]
6. Gybbons RJ, Nygaard M. Synthesis of insoluble dextran and its significance in the formation of gelatinous deposits by plaqueforming streptococci. Arch Oral Biol. 1968;13(10):1249-62. [ Links ]
7. Grössner-Schreiber B, Griepentrog M, Haustein I, Müller WD, Lange KP, Briedigkeit H, et al. Plaque formation on surface modified dental implants. An in vitro study. Clin Oral Implants Res. 2001;12(6):543-51. [ Links ]
8. Grössner-Schreiber B, Hannig M, Duck A, Grietentrog M, Wenderoth DF. Do different implant surfaces exposed in the oral cavity of humans show different biofilm compositions and activities? Eur J Oral Sci. 2004;112(6):516-22. [ Links ]
9. Heuer W, Elter C, Demling A, Neumann A, Suerbaum S, Hannig M, et al. Analysis of early biofilm formation on oral implants in man. J Oral Rehabil. 2007;34(5):377-82. [ Links ]
10. Idone V, Brendtro S, Gillespie R, Kocaj S, Peterson E, Rendi M, et al. Effect of an orphan response regulator on Streptococcus mutans sucrose-dependent adherence and cariogenesis. Infect Immun. 2003;71(8):4351-60. [ Links ]
11. Jansson H, Hamberg K, De Bruyn H, Bratthall G. Clinical consequences of IL-1 genotype on early implant failures in patients under periodontal maintenance. Clin Implant Dent Relat Res. 2005;7(1):51-9. [ Links ]
12. Jendresen MD, Glantz PO. Clinical adhesiveness of selected dental materials. An in-vivo study. Acta Odontol Scand. 1981;39(1):39-45. [ Links ]
13. Liljemark WF, Bloomquist C. Human oral microbial ecology and dental caries peridontal diseases. Crit Rev Oral Biol Med. 1996;7(2):180-98. [ Links ]
14. Lindhe J, Berglundh T, Ericsson I, Liljenberg B, Marinello C. Experimental breakdown of peri-implant and periodontal tissues. A study in the beagle dog. Clin Oral Implants Res.1992;3(1):9-16. [ Links ]
15. Marcacci S, Lamping R, Maekawa, LE, Pavanelli CA, Nogueira L Jr, Koga-Ito CY. Aderência de Candida albicans em ligas de titânio e cobalto-cromo, com difrerentes desgastes. Rev Sul-bras Odontol. 2008;5(1):7-12. [ Links ]
16. Mombelli A, Lang NP. The diagnosis and treatment of periimplantitis. Periodontol 2000. 1998;17:63-76. [ Links ]
17. Nakazato G, Tsuchiya H, Sato M, Yamauchi M. In vivo plaque formation on implant materials. Int J Oral Maxillofac Implants. 1989;4(4):321-6. [ Links ]
18. Ong ES, Newman HN, Wilson M, Bulman JS. The occurrence of periodontitis-related microorganisms in relation to titanium implants. J Periodontol. 1992;63(3):200-5. [ Links ]
19. Persson GR, Salvi GE, Heitz-Mayfield LJ, Lang NP. Antimicrobial therapy using a local drug delivery system (Arestin) in the treatment of peri-implantitis. I: microbiological outcomes. Clin Oral Implants Res. 2006;17(4):386-93. [ Links ]
20. Pongnarisorn NJ, Gemmell E, Tan AE, Henry PJ, Marshall RI, Seymour GJ. Inflammation associated with implants with different surface types. Clin Oral Implants Res. 2007;18(1):114-25. [ Links ]
21. Romeiro RL, Majewski M, Molina F, Junqueira JC, Oliveira L, Jorge AOC. Aderência de C. albicans, C. dubliniensis e C. glabrata à superfície de implantes lisos e rugosos. ImplantNews. 2009;6(1):33-7. [ Links ]
22. Shibli JA,Vitussi TR, Garcia RV, Zenóbio EG, Ota-Tsuzuki C, Cassoni A, et al. Implant surface analysis and microbiologic evaluation of failed implants retrieved from smokers. J Oral Implantol. 2007;33(4):232-8. [ Links ]
23. Silva CHP,Vidigal GM Jr, Uzeda M, Soares GA. Influence of titanium surface roughness on attachment of Streptococcus sanguis: an in vitro study. Implant Dent. 2005;14(1):88-93. [ Links ]
24. Walker C, Sedlacek MJ. An in vitro biofilm model of subgengival plaque. Oral Microbiol Immunol. 2007;22(3):152-61. [ Links ]
25. Wu-Yuan CD, Eganhouse KJ, Keller JC, Walters KS. Oral bacterial attachment to titanium surfaces: a scanning electron microscopy study. J Oral Implantol. 1995;21(3):207-13. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Rogério de Lima Romeiro
Av. Bernardino de Campos, 358 Centro
12600-000 - Lorena - São Paulo - Brasil
E-mail: rogerio.romeiro@terra.com.br
Recebido: 06/06/2010
Aceito: 30/07/2010













