Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Innovations Implant Journal
versão On-line ISSN 1984-5960
Innov. Implant. J., Biomater. Esthet. (Online) vol.5 no.2 São Paulo Mai./Ago. 2010
ARTIGOS CIENTÍFICOS
PRP ou BMPs: qual a melhor opção para enxertia e aceleração de osseointegração nas reabilitações com implantes? revisão de literatura
PRP or BMPs: what is the best option for grafting and acceleration of osseointegration in rehabilitation with implants? literature review
Caio Cesar de Souza Loureiro
Cirurgião buco maxilo facial, São Sebastião, SP, Brasil
RESUMO
Nos últimos anos, a reabilitação oral através da instalação de implantes osseointegrados vem sendo cada vez mais difundida e realizada. O sucesso do tratamento está diretamente associado à qualidade e quantidade do tecido ósseo presentes, favorecendo ou não o procedimento. Na ausência de condições favoráveis o cirurgião pode lançar mão de técnicas que visam promover o aumento de volume e qualidade óssea do espaço protético, através de enxertos, para a posterior instalação dos implantes resultando, porém, em um prolongamento do período de tratamento. Mesmo diante de condições ideais, a reabilitação protética depende fundamentalmente do processo de neoformação óssea ao redor de implante, que leva de 4 a 6 meses para ocorrer de forma satisfatória, de modo a suportar a carga mastigatória sem risco de mobilização e eventual perda dos implantes. Com o intuito de acelerar o processo de osseointegração, ou de maturação óssea de enxertos, fatores de crescimento capazes de induzir e acelerar a neoformação óssea presentes no plasma rico em plaquetas (PRP) e nas proteínas morfogenéticas ósseas (BMPs) vêm sendo amplamente utilizados. O objetivo deste trabalho é comparar a efetividade do PRP e das BMPs através da revisão de literatura.
Palavras-chave: Plasma rico em plaquetas. Proteínas morfogenéticas ósseas. Regeneração óssea.
ABSTRACT
In recent years, the oral rehabilitation through the installation of dental implants is becoming more widespread and carried out. Treatment success is directly associated with quality and quantity of bone tissue present, or may favor or not the procedure. In the absence of favorable conditions for the surgeon may resort to techniques that promote increased bone volume and quality of the abutment, by grafting, for the subsequent installation of implants resulting, however, a longer treatment period. Even with ideal conditions, the prosthetic rehabilitation depends mainly on the process of bone formation around the implant, which takes 4-6 months to occur satisfactorily, to withstand the masticatory load without risk of mobilization and eventual loss of the implants. Aiming to accelerate the process of osseointegration or bone graft maturation, growth factors capable of inducing and accelerating bone formation present on the plateletrich plasma (PRP) and bone morphogenetic proteins (BMPs) have been widely used. The aim of this study is to compare the effectiveness of the RPP and BMPs through a literature review.
Key words: Platelet-rich plasma. Bone morphogenetic proteins. Bone regeneration.
INTRODUÇÃO
Desde os primeiros estudos publicados por Brånemark4 no final da década de 60 até os dias atuais, a utilização de implantes osseointegrados vem crescendo em grande proporção. O processo de neoformação óssea ao redor da superfície dos implantes vem sendo exaustivamente estudado, permitindo o desenvolvimento de novos sistemas e técnicas cada vez mais apuradas para sua instalação, visando um melhor resultado cirúrgico-protético que atenda às necessidades e expectativas de pacientes cada vez mais exigentes quanto aos resultados de seus tratamentos1.
Ainda assim, a reabilitação oral através da implantodontia ainda esbarra em obstáculos que independem da técnica cirúrgica ou do sistema de implantes utilizado.
O primeiro obstáculo diz respeito ao período de tratamento, uma vez que após a instalação dos implantes é necessário aguardar um período médio de 4 a 6 meses para que o processo de osseointegração ocorra de maneira ao menos satisfatória para evitar a movimentação do implantes sob cargas mastigatórias após a instalação das próteses, que eventualmente possam levar à perda do implante.
O segundo problema está relacionado à quantidade e à qualidade do osso no qual se pretende confeccionar a prótese sobre implantes. Pacientes que se apresentam para tratamento relatando perda dentária há muito tempo são, em um primeiro momento, alvos de preocupação uma vez que já é esperada uma deficiência óssea importante, seja por reabsorção, seja pela pneumatização dos seios maxilares, o que, em tese, inviabilizaria o procedimento. Através das técnicas de enxertia, é possível restabelecer o volume e melhorar a qualidade do trabeculado ósseo permitindo em um segundo momento a realização do procedimento de instalação dos implantes. Esta opção terapêutica apresenta dois inconvenientes: 1) a necessidade de dois procedimentos cirúrgicos, o que não chega a ser exatamente um problema desde que haja a concordância do paciente, entretanto aumenta o período de tratamento e 2) a necessidade de uma rápida formação de um tecido cicatricial que permita a adesão e principalmente a vascularização do enxerto, evitando assim sua reabsorção ou perda1,6.
Fica evidente, portanto, que para ambos os casos é necessário criar meios de acelerar o processo de neoformação óssea6.
Atualmente, tem se lançado mão da utilização de proteínas, denominadas fatores de crescimento, que quando aplicadas, seja na loja óssea preparada para receber o implante, seja no material de enxerto, intensificam o processo de quimiotaxia das células responsáveis pela reparação tecidual, promovendo a aceleração da formação e maturação de tecido ósseo1,5,15.
A aplicação destes fatores de crescimento é realizada através da utilização de duas fontes distintas: o plasma rico em plaquetas (PRP) que durante o processo de cicatrização libera fatores de crescimento como fator de crescimento derivado de plaquetas (PDGF), fator de crescimento similar a insulina (IGF) e o fator de crescimento transformador beta (TGF-b) e as proteínas morfogenéticas ósseas (BMPs) responsáveis pela atividade osteoindutiva da matriz óssea orgânica, identificados como sendo membros da família dos TGF-β3,5,8,15.
O objetivo deste trabalho é fazer um estudo comparativo entre o PRP e as BMPs avaliando seu potencial de indução de osteogênese, assim como as vantagens e as desvantagens dos seus usos, através de uma revisão sistemática da literatura.
REVISÃO DE LITERATURA
PLASMA RICO EM PLAQUETAS (PRP)
No período pós-operatório, o coágulo sanguíneo inicia o processo de cicatrização e regeneração dos tecidos lesados. Este processo se dá, inicialmente, através da ativação e liberação de inúmeros fatores de estímulo presentes nas plaquetas que podem promover a neoformação óssea, epitelial e vascular1,5.
Tendo isto em vista, pode-se acreditar que o aumento no volume da plaquetas presentes nas feridas cirúrgicas, aumentam proporcionalmente o processo regenerativo tecidual.
Durante muitos anos, o PRP foi utilizado como principal fonte de fatores de crescimento associada à instalação de implantes osseointegrados e enxertos ósseos orais e maxilofaciais. É um produto orgânico, atóxico e não imunorreativo, que propicia a aceleração das etapas da cicatrização da ferida cirúrgica6.
O PRP é obtido através da centrifugação de sangue autógeno, produzindo um pequeno volume de plasma com alta concentração de plaquetas em suspensão. Com este processo, é possível elevar a quantidade de plaquetas que é em média de 200.000/ml de sangue, para uma concentração de até 1.000.000/ml8,10-11. Quando combinado com trombina e cloreto de cálcio produz em gel viscoso que pode ser facilmente colocado na loja óssea ou incorporado ao material de enxerto8,10.
A ação do PRP se dá através da de granulação dos grânulos a plaquetários, liberando proteínas (fatores de crescimento) envolvidas no início e manutenção do processo de reparação tecidual. Os principais fatores de crescimento derivados dos grânulos aplaquetários e responsáveis por este processo são o PDGF, o TGF-b e o IGF, além de outros componentes da matriz extracelular como a fibronectina, a trombospondina e a vitronectina5-6,8,11.
O PDGF é um quimiotático para células polimorfonucleares, macrófagos, fibroblastos e células da musculatura lisa, além de estimular a replicação celular de células endoteliais e produção de fibronectina e ácido hialurônico. Atua sobre a atividade mitogênica dos osteoblastos estimulando a resposta ósseoindutora em enxertos de osso desmineralizados5-6,10.
O TGF-b, por sua vez, estimula a síntese de DNA ósseo e a replicação celular, demonstrando serem os osteoblastos as células mais sensíveis à ação desse fator, além de estimular a quimiotaxia de fibroblastos e a produção de colágeno e fibronectina. Mais do que isto, o TGF-b também inibe a degradação do colágeno através da ativação de inibidores de proteases, favorecendo a fibrogênese5-6,10.
Os IGFs (IGF-I e IGF-II) são mitogênicos para as células de linhagem osteoblásticas e estimuladores de osteogênese, a partir dos osteoblastos diferenciados já existentes. Participam da diferenciação de células competentes, como também na migração, proliferação de células, síntese e secreção dos produtos que caracterizam as linhagens celulares específicas, no caso osteoblastos, regulando a formação óssea por via autócrina ou parácrina, com elevação da síntese de DNA, de osteocalcina e da atividade da fosfatase alcalina6.
PROTEÍNAS MORFOGENÉTICAS ÓSSEAS (BMPS)
BMPs formam um grupo único de proteínas dentro da superfamília do TGF-ß e têm um papel fundamental na regulação da indução, manutenção e reparação óssea em diversas situações clínicas. Além de exercerem um papel fundamental na formação de órgãos como coração, folículo piloso, botão dentário, mesênquima crâniofacial, rins, fígado, pulmão, sistema nervoso central3,12,15,17. Até o momento, cerda de 20 tipos de BMP já foram identificadas todas com diferentes graus de atividade celular, incluindo propriedades de indução cartilaginosa ou óssea2-3,15.
Estas proteínas atuam, principalmente, como agentes quimiotáticos, mitogênicos e sobre diferenciação de células mesenquimais indiferenciadas, induzindo-os a se diferenciar em osteoblastos e, em algumas situações, condroblastos7,16-18. Osso induzido pelas BMPs apresenta todas as características de osso normal, inclusive formação de cartilagem seguida por ossifi cação endocondral18.
As BMPs estão presentes na matriz óssea e podem ser obtidas e purificadas desde tecidos alógenos ou xenógenos, apresentando função semelhante uma vez que apresentam homologia estrutural e funcional independente da espécie animal das quais foram extraídas7,9,14-15. Atualmente, sua obtenção se dá através da engenharia genética graças à tecnologia do DNA recombinante para isolar, identificar, clonar e expressar alguns tipos de BMPs, tendo em vista que para obter-se essa proteína purificada, seria necessário cerca de um quilograma de osso para poucos microgramas de BMP15. Inicialmente, a utilização da matriz óssea bovina (bBMP) foi estimulada como uma alternativa ao osso alógeno, devido às controvérsias geradas quanto à atividade osteoindutiva, à segurança biológica e às questões ético-legais da comercialização de ossos humanos12. Em 1999, a FDA (US Food and Drug Administration) aprovou a utilização de proteínas humanas como auxiliar dos processos cicatriciais e regenerativos3,15-16.
Com isto, diversos estudos passaram a ser realizados com proteínas morfogenéticas ósseas recombinantes humanas (rhBMP), tendo sido constatada maior eficácia nos processos de enxertia e regeneração óssea das proteínas dos tipos 2 e 7 (rhBMP-2 e rhBMP-7) que, graças ao seus maiores potenciais osteoindutores, passaram a ser produzidas em grande escala e atualmente se encontram no mercado2,7. Estudos demonstraram, entretanto, que devido à falta de estrutura física, as rhBMPs exigem o uso de um carreador que, inicialmente, impeça o crescimento de tecido fibroso ou de tecido muscular dentro do defeito ósseo e, posteriormente, permitam uma rápida invasão de vasos sanguíneos e células mesenquimais, sendo degradado e reposto por um tecido pré-ósseo, além de controlar a distribuição das proteínas, retendo-as por um período determinado para que ocorra a indução celular5-6. Dentre as diversas opções de materiais que podem ser utilizados como carreadores, as esponjas de colágeno absorvível (ACS), tem sido a melhor opção de escolha15.
As BMPs encontradas no mercado são comercializadas na forma de pó liofilizado em frasco estéril, que no momento da cirurgia, é reconstituído com água estéril e associado ao carreador, sendo então entregue ao leito cirúrgico3.
A correta manipulação é fundamental para o sucesso do procedimento, tendo em vista que a efetividade das BMPs pode ser afetada por diversos fatores como: quantidade, composição qualitativa, a possível presença de inibidores, correto processamento e armazenamento. Além disso, a dose, concentração e tempo de ação das BMPs são importantes parâmetros do resultado indutivo17.
DISCUSSÃO
PRP X BMPS
A implantodontia pode ser considerada atualmente a gold standard das opções terapêuticas para a reabilitação oral. Sua utilização, no entanto, depende de condições ideais para a instalação dos implantes, principalmente no que diz respeito à qualidade e quantidade óssea do leito receptor9,18.
Mais do que isto, a exigência dos pacientes por uma correta reabilitação no menor período de tempo possível exige da equipe profissional a busca por materiais que permitam a aceleração do processo de osseointegração, acelerando consequentemente a confecção e instalação dos elementos protéticos18.
Neste sentido, a utilização de dos fatores de crescimento tem sido uma opção cada dia mais utilizada com o intuito de promover uma resposta tecidual mais rápida e eficiente, graças a sua atuação sobre as atividades mitogênicas, de quimiotaxia e de ativação de células responsáveis pelo processo cicatricial, seja na interface implante-osso, seja na estrutura dos materiais de enxerto5,10.
Com este propósito, pode-se lançar mão de duas fontes de fatores de crescimento, o PRP e as BMPs.
Ao utilizar a literatura como fonte de referência para a comparação da efetividade, as vantagens e desvantagens de cada uma destas fontes, obtém-se uma quantidade enorme de informações, muitas delas conflitantes e que dificultam a compreensão e uma análise crítica apurada para decidir qual a melhor opção de escolha. Isto se deve principalmente à ausência de estudos científi cos confi áveis que promovam a comparação da ação do PRP e das BMPs.
Dentre as referências utilizadas neste trabalho, apenas o trabalho de Roldan e equipe13 apresenta um trabalho comparando a efetividade entre PRP e rhBMP-7 para enxerto em porcos, com uma amostra extremamente reduzida (n = 5). Neste estudo, o uso do rhBMP-7 foi mais eficiente que o PRP em enxertos para elevação de seio maxilar. Entretanto, as condições do estudo tornam os resultados pouco confi áveis.
Deste modo, a comparação entre os dois sistemas só é possível através do cruzamento de informações obtidas na literatura específi ca sobre cada uma destas fontes de fatores de crescimento.
No que diz respeito à efetividade, diversos estudos demonstram que tanto o PRP quanto as BMPs são capazes de promover a aceleração do processo cicatricial, acelerando, não apenas a deposição óssea como também o processo de angiogênese1-18. Entretanto, as repostas obtidas quando do uso do PRP são muito variáveis, deixando dúvidas quanto ao seu real potencial de indução da neoformação óssea11.
A variabilidade dos resultados obtidos com o uso do PRP pode ser explicada por diversos fatores. O principal deles está relacionado ao processo de obtenção do PRP. De acordo com o autor, o processo de centrifugação do sangue deve ser realizado em ambiente estéril e de forma que, durante o processo de separação das plaquetas, estas não sejam lisadas ou danificadas impedindo a liberação dos fatores de crescimento. Mais do que isto, Marx afirma que muitos estudos foram realizados através da obtenção de PRP utilizando sangue homógeno e não autógeno o que levaria à uma resposta imunológica do hospedeiro, inviabilizando a ação plaquetária11.
Quando os estudos são realizados dentro dos corretos padrões, observa-se um aumento de 2 a 3 vezes na velocidade de neoformação óssea8,11.
Quanto às BMPs, seu potencial no uso para o tratamento de defeitos ósseos vem sendo alvo de estudos desde a publicação dos resultados do estudo de Urist em 196519, que promoveu a indução de neoformação óssea em sítios ectópicos, dentre eles, tecido muscular e subcutâneo, implantando fragmentos ósseos desmineralizados. Foram necessárias, porém, três décadas até que as proteínas responsáveis por este processo fossem isoladas e devidamente clonadas para que pudessem chegar ao mercado, obtendo-se resultados satisfatórios no processo de ósseoindução. Ainda assim, os estudos realizados não quantificam o aumento da velocidade de osteoindução quando do uso das BMPs15.
Assim, pode-se afirmar que, de acordo com a literatura, os resultados sobre a efetividade tanto do PRP quanto das BMPs são promissores, desde que sejam respeitadas suas técnicas de obtenção e manipulação durante o procedimento cirúrgico.
Se ambos apresentam bons potenciais no que diz respeito ao potencial de indução de formação óssea, quando se fala de vantagens e desvantagens, passamos a avaliar, principalmente duas questões: técnica de utilização e custo.
O PRP é obtido de forma simples e rápida, podendo ser preparado, inclusive, durante o procedimento cirúrgico, enquanto o leito cirúrgico é preparado. O uso de sangue autógeno é, sem dúvida, uma das maiores vantagens do uso do PRP. Primeiro porque a utilização do plasma autógeno impossibilita as eventuais reações imunológicas que inviabilizariam o uso do enxerto ou a instalação dos implantes. Em segundo lugar, diminui consideravelmente o custo do procedimento, uma vez que o fornecedor da matéria-prima é o próprio paciente, podendo-se obter facilmente a quantidade necessária de acordo com a necessidade. Por outro lado, sua técnica de obtenção é sensível e erros na centrifugação e manipulação do plasma podem inativar as plaquetas, inutilizando o PRP5,7,17.
As BMPs, por sua vez, já são apresentadas em forma de pó liofilizado em ambiente estéril e prontas para a utilização, eliminando a necessidade de uma outra equipe em campo para seu preparo. Por sua atividade ser dose dependente, maiores defeitos ósseos demandam de maior quantidade de BMPs. Tendo em vista que sua obtenção é realizada, atualmente, através das técnicas de engenharia genética, o seu custo no mercado é elevado e proporcional à necessidade do paciente. Associado a isto, vale lembrar que sua efetividade depende também do uso de carreadores que vão desde as esponjas de colágeno aos polímeros sintéticos e osso alógeno2,7,15.
A titulo de comparação, as características do PRP e das BMPs estão listadas na Tabela 1.
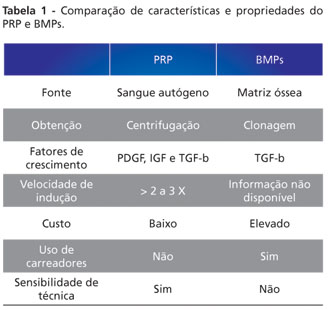
CONCLUSÃO
O uso dos fatores de crescimento através do PRP ou das BMPs tem aumentado significativamente nos procedimentos de reabilitação oral através da implantodontia.
A literatura sobre o assunto, infelizmente, apresenta informações contraditórias e estudos pouco confiáveis quanto aos seus resultados.
Entretanto, o cruzamento de informações nos permite criar um panorama favorável para o uso tanto do PRP, quanto das BMPs. A escolha de qual fonte de fatores de crescimento a ser utilizada cabe, portanto, ao profissional que deve observar atentamente as condições de obtenção, manipulação e também o custo do procedimento.
Mais do que isto, fica evidente a necessidade de maiores estudos comparativos entre o PRP e as BMPs, dentro de padrões adequados, para que se possa demonstrar, com segurança, se algum dos sistemas apresenta maior efi cácia.
REFERÊNCIAS
1. Anitua E. Enhancement of osseointegration by generating a dynamic implant surface. J Oral Implantol. 2006;32(2):72-6. [ Links ]
2. Becker J, Kirsch A, Schwarz F, Chatzinikolaidou M, Rothamel D, Lokovic V, et al. Bone apposition to titanium implants biocoated with recombinant human bone morphogenetic protein-2 (rhBMP-2). A pilot study in dogs. Clin Oral Investig. 2006;10(3):217-24. [ Links ]
3. Block MS, Achong R. Bone morphogenetic protein for sinus augmentation. Atlas Oral Maxillofac Surg Clin North Am. 2006;14(1):99-105. [ Links ]
4. Brånemark P-I, Adell R, Breine U, Hansson BO, Lindström J, Ohlsson A. Intra-osseous anchorage of dental prostheses. I. Experimental studies. Scand J Plast Reconstr Surg. 1969;3(2):81-100. [ Links ]
5. Carlson NE, Roach RB Jr. Platelet-rich plasma: clinical applications in dentistry. J Am Dent Assoc. 2002;133(10):1383-6. [ Links ]
6. Feres F Jr, Passanezi E, Greghi SLA, Passanezi A.Análise comparativa do índice de sucesso dos implantes osteointegrados com e sem a utilização de PRP, no protocolo de fixação. Semina Ciênc Biol Saúde. 2004;25(1):9-22. [ Links ]
7. Gonçalves EAL, Guimarães SAC, Garcia RB. Proteínas morfogenéticas ósseas: terapêutica molecular no processo de reparo tecidual. Rev Odontol Univ São Paulo. 1998;12(3):299-304. [ Links ]
8. Grageda E, Lozada JL, Boyne PJ, Caplanis N, McMillan PJ.Bone formation in the maxillary sinus by using platelet-rich plasma: an experimental study in sheep. J Oral Implantol. 2005;31(1):2-17. [ Links ]
9. Lourenço EJV. Avaliaçäo da osteogênese com proteínas ósseas morfogenéticas (BMPs): análise em defeitos na calvária e ao redor de implantes de titânio em coelhos [thesis]. Bauru (SP): Faculdade de Odontologia de Bauru, Universidade de São Paulo; 2002. [ Links ]
10. Lozada JL, Caplanis N, Proussaefs P, Willardsen J, Kammeyer G. Platelet-rich plasma application in sinus graft surgery: Part I--Background and processing techniques. J Oral Implantol. 2001;27(1):38-42. [ Links ]
11. Marx RE. Platelet-rich plasma: evidence to support its use. J Oral Maxillofac Surg. 2004;62(4):489-96. [ Links ]
12. Mendonça RG, Freitas AC, Ramalho LP, Farias JG, Ribeiro MMB. Avaliação histológica do processo de reparo ósseo após implantação de BMPs. Pesq Bras Odontoped Clin Integr. 2007;7(3):291-6. [ Links ]
13. Roldan JC, Jepsen S, Schmidt C, Knüppel H, Rueger DC, Açil Y, et al. Sinus floor augmentation with simultaneous placement of dental implants in the presence of platelet-rich plasma or recombinant human bone morphogenetic protein-7. Clin Oral Implants Res 2004;15(6):716-23. [ Links ]
14. Santos AA, Miranda CDO, Alves MTS, Faloppa F. O papel da proteína morfogenética óssea na reparação do tecido ósseo. Acta Ortop. Bras. 2005;13(4):194-5. [ Links ]
15. Schmidt C. Futuro da odontologia impregnado com BMP. Innov Implant J, Biomater Esthet. 2006;1(2):19-24. [ Links ]
16. Simon Z, Watson PA. Biomimetic dental implants - new ways to enhance osseointegration. J Can Dent Assoc. 2002;68(5):286-8. [ Links ]
17. Sykaras N, Opperman LA. Bone morphogenetic proteins (BMPs): how do they function and what can they offer the clinician? J Oral Sci. 2003;45(2):57-73. [ Links ]
18. Ueda JK, Francischone CE, Ramalho LTO, Scarso J Filho. Estudo comparativo da substituição óssea frente a enxerto de osso autógeno e proteína morfogenética óssea ao lado de implantes de titânio. Rev. Dental Press Periodontia Implantol. 2007;1(1):76-84. [ Links ]
19. Urist, M. Bone: formation by autoinduction. Science. 1965;150(698):893-9. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Caio Cesar de Souza Loureiro
Rua Prefeito Mansueto Pierotti, 966
11600-000 - São Sebastião - São Paulo - Brasil
E-mail: csloureiro@gmail.com
Recebido: 31/05/2010
Aceito: 05/07/2010













