Serviços Personalizados
Artigo
Links relacionados
Compartilhar
Innovations Implant Journal
versão On-line ISSN 1984-5960
Innov. Implant. J., Biomater. Esthet. (Online) vol.5 no.3 São Paulo Set./Dez. 2010
ARTIGOS CIENTÍFICOS
Revisão sistemática sobre o uso de células-tronco mesenquimais em terapias de perdas ósseas
Systematic review of use of mesenchymal stem cells in bone loss therapies
Igor Iuco Castro-SilvaI; Lawrence Andrade Costa da Rocha CoutinhoII; José Mauro GranjeiroIII
IMestre em Patologia. Professor Substituto do Departamento de Biologia Celular e Molecular, Universidade Federal Fluminense, Niterói, RJ, Brasil
IIEspecialista em Geriatria e Gerontologia. Fisioterapeuta Supervisor da Associação Fluminense de Reabilitação, Niterói, RJ, Brasil
IIIProfessor Adjunto do Departamento de Biologia Celular e Molecular, Instituto de Biologia, Universidade Federal Fluminense, Niterói, RJ, Brasil. Pesquisador-Sênior do Instituto Nacional de Metrologia, Normalização e Qualidade Industrial, Duque de Caxias, RJ, Brasil
RESUMO
Terapias de perdas ósseas com células-tronco mesenquimais sugerem uma promissora perspectiva de uso em cirurgias orais reconstrutivas. O objetivo deste estudo foi realizar um levantamento bibliográfico dos últimos 15 anos com trabalhos experimentais temáticos para traçar um perfil de metodologias e resultados alcançados nesta área. Um destacável crescimento de publicações ocorreu em países economicamente desenvolvidos. A medula óssea se mantém como a principal fonte tecidual de células-tronco mesenquimais (79,31%), caracterizadas por adesão, imunofenotipagem e multipotência, capazes de promover a osteogênese in vitro. Embora exista pluralidade de modelos experimentais in vivo (espécies animais) e clínicos (sítios anatômicos), há prevalência de testes pré-clínicos de terapia celular (27,03%), que indicam boa bicompatibilidade tecidual e osteogênese aumentada pós-enxerto. Estudos clínicos têm relatado resultados positivos para o tratamento de defeitos periodontais, rebordo alveolar deficiente, fenda alveolar congênita, defeitos cranianos extensos, levantamento de seio maxilar e atrofia mandibular pós-irradiação. Os biomateriais carreadores de células mais utilizados foram biocerâmicas a base de hidroxiapatita (11,16%), seguidos por polímeros a base de colágeno (5,42%) ou poliácido lático (5,30%) e compósitos baseados em fosfatos de cálcio (3,71%). Conclui-se que a utilização de células-tronco mesenquimais representa novos e eficazes procedimentos terapêuticos para regeneração óssea em Odontologia e Medicina.
Palavras-chave: Células-tronco. Materiais biocompatíveis. Osteogênese.
ABSTRACT
Bone loss therapies using mesenchymal stem cells suggest a promising prospect for use in oral reconstructive surgeries. The aim of this study was to review the literature of the past 15 years with experimental theme to draw a profile of methodologies and results achieved in this area. A remarkable growth of publications occurred in economically developed countries. The bone marrow remains the main source of tissue mesenchymal stem cells (79.31%), characterized by adherence, immunophenotyping and multipotency, which can promote osteogenesis in vitro. Although there is a plurality of experimental models in vivo (animal species) and clinical studies (anatomical sites), there is prevalence of preclinical trials of cell therapy (27.03%), indicating good tissue biocompatibility and the highest osteogenesis after graft. Clinical studies have related positive results in the treatment of periodontal defects, alveolar ridge deficiency, congenital alveolar cleft, extensive cranial defects, maxillary sinus lifting and mandibular atrophy after radiation. The most used biomaterials as cell carriers were hydroxyapatite-based bioceramics (11.16%) followed by collagen- (5.42%) or poly lactic acid- (5.30%) based polymers and calcium phosphates-based composites (3.71%). We concluded that the use of mesenchymal stem cells represent new and effective therapeutic tools for bone regeneration in dentistry and medicine.
Key words: Stem cells. Biocompatible materials. Osteogenesis.
INTRODUÇÃO
O tratamento de defeitos ósseos extensos advindos de traumas ou patologias constitui um desafio para a regeneração tecidual, em especial para cirurgia craniomaxilofacial e ortopédica8. Visando superar a morbidade de enxertos autógenos e as limitações de enxertos alógenos, xenógenos e aloplásticos, têm se desenvolvido muitos estudos relacionados à terapêutica com base nos fundamentos da Bioengenharia, utilizando células-tronco mesenquimais (CTM) e dispositivos implantáveis para favorecer o processo regenerativo8,15. Estas células possuem capacidade de autorenovação e diferenciação múltipla, vistas como reservatórios presentes no corpo humano até que, sob estímulos locais, haja mobilização e direcionamento ao reparo ósseo9.
Buscando traçar um perfil de metodologias utilizadas e graus de eficácia em terapia celular segundo as publicações mais recentes, o objetivo deste estudo retrospectivo foi analisar os trabalhos realizados com a temática de CTM e terapia de perdas ósseas.
MATERIAL E MÉTODOS
Foi realizado um levantamento bibliográfico de artigos publicados em periódicos entre janeiro de 1995 e dezembro de 2009, através do banco de dados eletrônico Pubmed (www.ncbi.nlm.nih.gov), utilizando como descritores "mesenchymal stem cell" e "bone". Em busca não-refinada, foi recuperado neste período um expressivo número de referências bibliográficas internacionais na língua inglesa (6.151). Para a padronização de resultados, foram selecionados apenas artigos experimentais e casos clínicos dentro da temática de reparo ósseo, o que contabilizou um somatório final de 1.624 artigos distintos, classificados nas seguintes variáveis: 1) distribuição temporo-espacial das publicações temáticas, 2) tipo de CTM de acordo com o período natal, 3) critério de identificação de CTM, 4) fonte tecidual doadora de CTM, 5) modelo de caracterização biológica (in vitro, in vivo ou clínica), 6) sítio anatômico receptor de CTM, 7) modelo animal doador e receptor de CTM, 8) tipo de biomaterial carreador de CTM e 9) tipos de defeitos ósseos tratados com CTM.
RESULTADOS
As publicações científicas temáticas no período de 1995 a 2002 tenderam ao crescimento linear discreto, seguido por aumento marcante até 2008 e um pico em 2009, com 1.624 artigos (100%) e caracterizando um comportamento polinomial de segunda ordem (R = 0.981) (Figura 1).
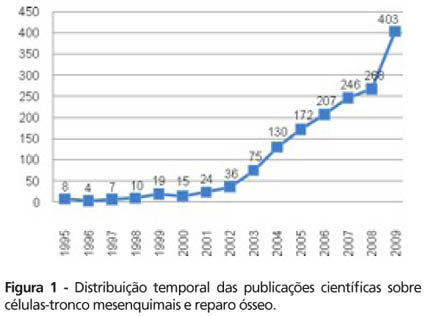
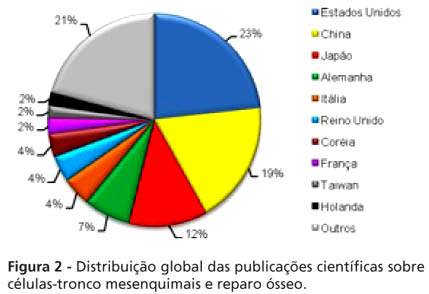
Com relação à distribuição geográfica, os 10 paises que produziram maior número de publicações dentro dos parâmetros avaliados estão representados na Figura 2. O Brasil ocupa o 19º lugar da lista geral, com 17 trabalhos (1,05% do total), entretanto toma a liderança na América Latina, à frente de países cuja taxa de publicação é inferior a 0,50%, como o Chile (8 ou 0,49%) e a Argentina (1 ou 0,06%).
Foi possível constatar a grande prevalência de estudos com células-tronco mesenquimais adultas ou pós-natais (94,15%) em comparação com as embrionárias ou pré-natais (7,88%).
A determinação fenotípica das CTM é difícil, pois elas exibem uma morfologia fibroblastóide inespecífica. Os critérios associativos mais usados para a identificação de CTM13, foram: aderência (97,11%), imunofenotipagem (35,78%) e multipotência (17,12%). Aderência é a fixação de CTM aos frascos plásticos para cultura de células em poucas horas de contato. Imunofenotipagem é a reação positiva entre um anticorpo-fluorocromo e um antígeno de superfície específico de CTM (CD105, CD73 ou CD90), via citometria de fluxo ou imunoistoquímica. Multipotência refere-se à capacidade da CTM, sob condições apropriadas, de diferenciar-se em pelo menos 3 tipos de células de mesma linhagem, que além de osteoblastos podem gerar adipócitos, condroblastos, fibroblastos, mioblastos, odontoblastos e endotélio; sua plasticidade pode ainda se estender a outras linhagens, como a transdiferenciação em neurônios, hepatócitos e células do pâncreas.
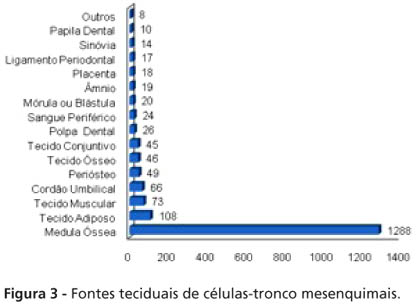
O isolamento de CTM tem sido realizado nos últimos 15 anos especialmente na medula óssea (79,31%). Fontes teciduais alternativas incluem: tecido adiposo (6,65%), tecido muscular (4,50%), sangue (2,52%) ou parede (1,54%) de cordão umbilical, periósteo (3,02%), tecido ósseo (2,83%), tecido conjuntivo de órgãos (pele: 0,86%; fígado: 0,49%; pulmão: 0,31%; mesênquima do palato e timo: 0,25% cada; seio maxilar ou aorta: 0,12% cada; tonsila palatina, intestino, baço, pâncreas, rim ou útero: 0,06% cada), polpa dental de dentes permanentes (1,11%) ou decíduos (0,49%), sangue periférico (1,48%), mórula ou blástula (1,23%), âmnio (1,17%), placenta (1,11%), ligamento periodontal (1,05%), sinóvia (0,86%) e papila dental (0,62%), dentre outras fontes (tecido cartilaginoso: 0,25%, hematoma de fratura: 0,18%, tendão: 0,06%) (Figura 3).
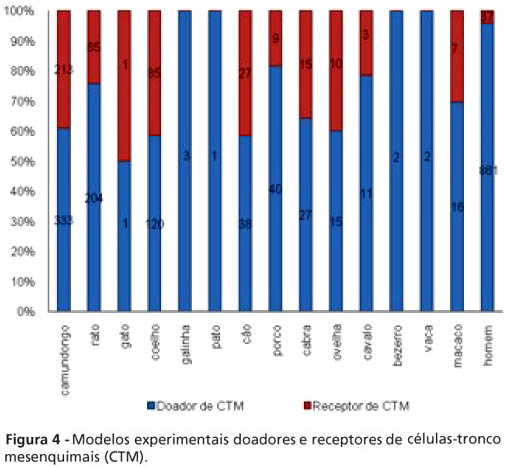
A pluralidade de modelos experimentais (espécies animais e sítios anatômicos) doadores e receptores de CTM também se faz presente. A origem humana é o principal alvo de estudos (53,02%), entretanto, a prevalência de animais de pequeno porte (camundongos: 13,12%, coelhos: 6,72% e ratos: 5,14%) como os maiores transplantados com CTM (xenógenas: 16,14%, autógenas: 10,84% ou alógenas: 7,64%) configura a etapa de testes pré-clínicos em que se encontram as terapias celulares, com poucos estudos clínicos relatados (2,28%) (Figura 4).
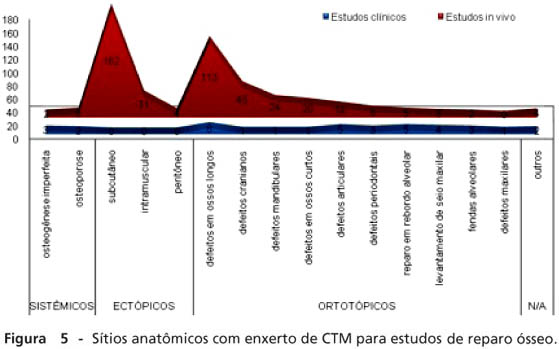
Os sítios anatômicos experimentais (estudos in vivo e clínicos) já utilizados para enxerto de CTM e estudos de reparo ósseo podem se classificar em: sistêmicos (0,95%), quando mostram alguma patologia óssea generalizada, ectópicos (15,59%), próprios para testes iniciais de biocompatibilidade, ou ortotópicos (21,04%), ideais para avaliar o comportamento osteogênico no sítio-alvo do enxerto de CTM, como demonstrados na Figura 5.
Os estudos in vitro (97,17%) demonstraram a capacidade de diferenciação óssea de CTM em condições apropriadas, usando meio de cultura (α-MEM, DMEM, DMEM:HAMF12 ou α-MEM:HAMF12) suplementado com soro (fetal bovino ou autógeno, 10%), dexametazona (10nM a 1µM), β-glicerosfosfato (10 µM a 10 mM) e ácido ascórbico (10 µM a 10 mM), onde a concentração usada dos agentes osteoindutores é importante fator na modulação tempo-resposta. A confirmação funcional do processo de diferenciação de CTM se dá pelo aumento da expressão de biomarcadores ósseos. Marcadores iniciais do processo são: CBFA-1/RUNX-2, osterix, TGF-β, BMP-2, colágeno I, fosfatase alcalina, osteonectina e osteopontina. Marcadores tardios são: osteocalcina, sialoproteína óssea, osteoprotegerina, depósitos de cálcio intracelulares e nódulos de mineralização23.
Os estudos in vivo (27,03%) mostraram biocompatibilidade tecidual e osteogênese no sítio de implantação, ectopicamente ou em defeitos ósseos induzidos. Enxerto de CTM em tecido subcutâneo promoveu mineralização em curto período (a partir de 3 semanas), constituindo um material bioativo e biocompatível (sem indução de resposta inflamatória intensa, reação de corpo estranho exacerbada e/ou focos de necrose)10,16. Em defeitos ósseos extensos ou críticos, CTM mediam osteogênese de 4 a 12 semanas pós-enxerto, refletindo o resultado positivo em defeitos cranianos22 e mandibulares12 como potencial aplicação à cirurgia craniofacial, e em defeitos femorais20, tibiais30 e radiais33 dentre outros, à cirurgia ortopédica.
A terapia celular usando CTM evolui no campo das pesquisas clínicas voltadas para o reparo ósseo (2,28%), com os principais progressos para a Odontologia demonstrados na Tabela 1. Resultados promissores surgem no tratamento de deformidades ósseas locais, de intensidade pequena (defeitos periodontais34) a moderada-grande (perda óssea horizontal em rebordo alveolar31, fenda alveolar18, traumatismos cranianos em crianças32) com bom padrão de reparo ósseo de 2 a 12 meses após o trauma, de acordo com o tamanho da lesão. Cirurgias orais com finalidade protética, tais como levantamento de seio maxilar28 e aumento vertical de mandíbula17, que visam o ganho ósseo para posterior ancoragem de implantes osseointegráveis de titânio, têm obtido boa previsibilidade clínica utilizando enxertos associados a CTM, com a formação de osso trabecular e lamelar 4 meses após o procedimento. De maior interesse ortopédico, a distração óssea indicada para ganho ósseo em comprimento em casos de pseudoartrose e acondroplasia foi gradual e concomitante ao enxerto de CTM e demonstrou formação de calo ósseo em tíbia e fêmur tratados21; de forma semelhante, lojas ósseas após curetagem de lesão central demonstraram ossificação em 4 semanas pós-enxerto25.

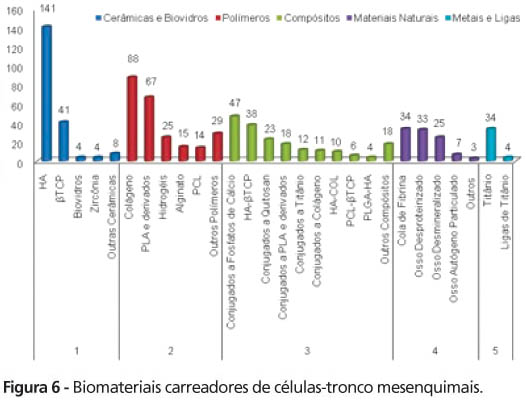
Existem duas vias de distribuição de CTM: sistêmica, por infusão sanguínea ou percutânea, baseada no homing que orienta a migração destas células para o sítio-alvo a ser reparado, aplicável em cirurgia cardiovascular9, ou tópica, que usa biomateriais carreadores sólidos ou gelatinosos, e aplica-se às cirurgias craniomaxilofacial e ortopédica8,15. As diferentes composições dos biomateriais carreadores de CTM estão expressas na Figura 6, onde se destaca o grupo das biocerâmicas, em especial a hidroxiapatita (HA, 11,16%), seguido por polímeros a base de colágeno (5,42%) e derivados de poliácido lático (PLA, 5,30%) e compósitos baseados em conjugações a fosfatos de cálcio (3,71%).
DISCUSSÃO
O crescimento acelerado das publicações sobre CTM e reparo ósseo é estimulado pela busca por melhor qualidade de vida, em especial para a considerável população mundial idosa8, e encorajado pelo aprimoramento tecnológico e maior investimento dos países em pesquisas de ponta. Adicionalmente, o quadro alarmante de edentulismo no Brasil se tornou um problema de Saúde Pública, com uma grande demanda populacional carente de reabilitação oral, e constituem hoje prioridade do Sistema Único de Saúde os tratamentos odontológicos restauradores6.
O uso de CTM adultas tem vantagens frente ao de embrionárias: aspectos legais e éticos não-limitantes de uso3, maior facilidade para a coleta, técnica rápida e clinicamente aplicável, não restrita ao âmbito de pesquisa como é o último caso4. Entretanto, a proporção de CTM adultas é muito baixa (0,001-0,01%) e decresce com a idade24. Desde o primeiro isolamento de CTM em 1966 por Friedenstein e Petrakova14, a medula óssea se mantém como a sua fonte mais prevalente, considerada o padrão-ouro. Para o cirurgião-dentista, o periósteo1 e a polpa dental7 representam fontes promissoras de CTM, devido à facilidade de coleta e menor morbidade do sítio doador do que a medula óssea humana11.
No Brasil, a Agência Nacional de Vigilância Sanitária regulamenta a coleta, o transporte e o armazenamento de células-tronco humanas em biobancos5, assim como o seu controle de qualidade e a sua utilização destinada à pesquisa clínica e terapia2.
Esta modalidade terapêutica mostra segurança biológica, embora a superação da barreira imunológica interespecífica no caso de xenotransplantes de CTM seja um desafio26. Não foram verificados casos de malignidade; CTM normais expressam genes inibidores de tumorigênese em escala significantemente maior do que os promotores deste processo27. Entretanto, existem poucas investigações a longo prazo em humanos, que devem ser conduzidas para melhor compreender sua efetividade e distribuição após implantação.
As composições encontradas nos biomateriais carreadores de CTM podem influenciar de diferentes formas o reparo ósseo8,15,19, favorecendo adesão e proliferação celular (colágeno, fibrina, cerâmica de alumina, plasma rico em plaquetas, polietilenoglicol/PEG, poli-ε-caprolactone/PCL, poliácido lático-coglicólico/PLGA, poli-N-isopropilacrilamida-co-ácido acrílico), osteodiferenciação (colágeno, HA, beta-tricálcio fosfato/βTCP, outros fosfatos de cálcio, PEG), angiogênese (cola de fibrina), penetração de células por poros (poligalactina 910), resistência mecânica (fibra de titânio, cerâmica de alumina) e reabsorção proporcional à reposição por novo osso (colágeno, βTCP, PLGA, matriz óssea desmineralizada). A união de composições diferentes pode gerar um biomaterial melhorado (compósito)29, sinergicamente favorável à ancoragem de CTM e potencializando a osteogênese no sítio-alvo.
CONCLUSÃO
Com base nos trabalhos avaliados pôde-se constatar que as células-tronco mesenquimais têm sido amplamente estudadas em pesquisas in vitro, in vivo e clínicas, demonstrando potencial osteogênico e eficácia no tratamento de defeitos ósseos, o que constitui perspectiva promissora para técnicas regenerativas em Odontologia e Medicina. Ainda é um desafio o desenvolvimento de carreadores para as células progenitoras, pois devem variar de acordo com a aplicação desejada. É estratégica a realização de estudos clínicos controlados e cegos a fim de avaliar o reparo ósseo, bem como o custo efetividade dos procedimentos de forma que os gestores em saúde possam tomar decisões informadas com base em evidências científicas.
REFERÊNCIAS
1. Agata H, Asahina I, Yamazaki Y, Uchida M, Shinohara Y, Honda MJ, et al. Effective bone engineering with periosteum-derived cells. J Dent Res. 2007;86(1):79-83. [ Links ]
2. Agência Nacional de Vigilância Sanitária. Consulta Pública n. 92, 1 dez. 2009. Minuta RDC/ANVISA. Regulamento técnico para o funcionamento de centros de tecnologia celular de células-tronco humanas [text on the Internet]. [cited 2010 Nov 17]. Available from: http://www4.anvisa.gov.br/base/visadoc/CP/CP%5B28867-1-0%5D.PDF [ Links ]
3. Brasil. Lei Federal no 9.434/1997. [text on the Internet]. [cited 2010 Nov 17]. Available from: http://www.planalto.gov.br/ccivil_03/Leis/L9434.htm [ Links ]
4. Brasil. Lei Federal no 11.105/1995. [text on the Internet]. [cited 2010 Nov 17]. Available from: http://www.planalto.gov.br/ccivil_03/_Ato2004-2006/2005/lei/L11105.htm [ Links ]
5. Brasil. Ministério da Saúde. Diretrizes nacionais para biorrepositórios e biobancos de material biológico humano com finalidade de pesquisa. Diário Oficial da União. 2010;47-8. [ Links ]
6. Brasil. Ministério da Saúde. Saúde Brasil 2008 - 20 anos de Sistema Único de Saúde (SUS) no Brasil [texto n the Internet]. Brasília: Ministério da Saúde; 2009 [cited 2010 Nov 17]. Available from: http://portal.saude.gov.br/portal/arquivos/pdf/saude_brasil_2008_web_20_11.pdf [ Links ]
7. Castro-Silva II, Alves GG, Castro LO, Ramirez CM, Granjeiro JM. Estudo preliminar da influência do laser de baixa intensidade (GaAlAs) na proliferação de células derivadas de polpa dental decídua humana. Innov. implant. j., biomater. esthet. (Impr.). 2009;4(2):48-52. [ Links ]
8. Castro-Silva II, Zambuzzi WF, Granjeiro JM. Panorama atual do uso de xenoenxertos na prática odontológica. Innov. implant. j., biomater. esthet. (Impr.). 2009;4(3):70-75. [ Links ]
9. Chamberlain G, Fox J, Ashton B, Middleton J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features and potential for homing. Stem Cells. 2007;25(11):2739-49. [ Links ]
10. Chen F, Ouyang H, Feng X, Gao Z, Yang Y, Zou X, et al. Anchoring dental implant in tissue-engineered bone using composite scaffold: A preliminary study in nude mouse model. J Oral Maxillofac Surg. 2005; 63(5):586-91. [ Links ]
11. De-Deus G, Canabarro A, Alves G, Linhares A, Senne MI, Granjeiro JM. Optimal cytocompatibility of a bioceramic nanoparticulate cement in primary human mesenchymal cells. J Endod. 2009;35(10):1387-90. [ Links ]
12. De Kok IJ, Peter SJ, Archambault M, van den Bos C, Kadiyala S, Aukhil I, et al. Investigation of allogenic mesenchymal stem-cells based alveolar bone formation: preliminary findings. Clin Oral Implants Res. 2003;14(4):481-9. [ Links ]
13. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(4):315-7. [ Links ]
14. Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV. Osteogenesis in transplants of bone marrow cells. J Embryol Exp Morphol. 1966;16(3):381-90. [ Links ]
15. Granjeiro JM. Papel dos biomateriais e da bioengenharia na medicina regenerativa. Innov. implant. j., biomater. esthet. (Impr.). 2006;1(2):16-7. [ Links ]
16. Hartman EH, Vehof JW, Spauwen PH, Jansen JA. Ectopic bone formation in rats: the importance of the carrier. Biomaterials. 2005;26(14):1829-35. [ Links ]
17. Hibi H, Yamada Y, Kagami H, Ueda M. Distraction osteogenesis assisted by tissue engineering in an irradiated mandible: a case report. Int J Oral Maxillofac Implants. 2006;21(1):141-7. [ Links ]
18. Hibi H, Yamada Y, Ueda M, Endo Y. Alveolar cleft osteoplasty using tissue-engineered osteogenic material. Int J Oral Maxillofac Surg. 2006;35(6):551-5. [ Links ]
19. Jardelino C, Takamori ER, Hermida LF, Lenharo A, Castro-Silva II, Granjeiro JM. Porcine peritoneum as source of biocompatible collagen in mice. Acta Cir Bras. 2010;25(4):332-6. [ Links ]
20. Kirker-Head C, Karageorgiou V, Hofmann S, Fajardo R, Betz O, Merkle HP, et al. BMP-Silk composite matrices heal critically sized femoral defects. Bone. 2007;41(2):247-55. [ Links ]
21. Kitoh H, Kitakoji T, Tsuchiya H, Mitsuyama H, Nakamura H, Katoh M, et al. Transplantation of marrow-derived mesenchymal stem cells and platelet-rich plasma during distraction osteogenesis – a preliminary result of three cases. Bone. 2004;35(4):892-8. [ Links ]
22. Krebsbach PH, Mankani MH, Satomura K, Kuznetsov SA, Robey PG. Repair of craniotomy defects using bone marrow stromal cells. Transplantation. 1998;66(10):1272-8. [ Links ]
23. Kulterer B, Friedl G, Jandrositz A, Sanchez-Cabo F, Prokesch A, Paar C, et al. Gene expression profiling of human mesenchymal stem cells derived from bone marrow during expansion and osteoblast differentiation. BMC Genomics. 2007;8:70. [ Links ]
24. Logeart-Avramoglou D, Anagnostou F, Bizios R, Petite H. Engineering bone: challenges and obstacles. J Cell Mol Med. 2005;9(1):72-84. [ Links ]
25. Morishita T, Honoki K, Ohgushi H, Kotobuki N, Matsushima A, Takakura Y. Tissue engineering approach to the treatment of bone tumors: three cases of cultured bone grafts derived from patients' mesenchymal stem cells. Artif Organs. 2006;30(2):115-8. [ Links ]
26. Poncelet AJ, Denis D, Gianello P. Cellular xenotransplantation. Curr Opin Organ Transplant. 2009;14(2):168-74. [ Links ]
27. Sawada R, Ito T, Tsuchiya T. Changes in expression of genes related to cell proliferation in human mesenchymal stem cells during in vitro culture in comparison with cancer cells. J Artif Organs. 2006;9(3):179-84. [ Links ]
28. Schmelzeisen R, Schimming R, Sittinger M. Making bone: implant insertion into tissue-engineered bone for maxillary sinus floor augmentation – a preliminary report. J Craniomaxillofac Surg. 2003;31(1):34-9. [ Links ]
29. Silva IIC, Pimentel-Soares S, Bittencourt RC, Granjeiro JM. Natural bovine anorganic apatite and collagen presents osteoconductivity and contribute to bone repair of rat calvaria critical size defect. Key Eng Mater. 2009;396-398:249-52. [ Links ]
30. Takushima A, Kitano Y, Harii K. Osteogenic potential of cultured periosteal cells in a distracted bone gap in rabbits. J Surg Res. 1998;78(1):68-77. [ Links ]
31. Ueda M, Yamada Y, Kagami H, Hibi H. Injectable bone applied for ridge augmentation and dental implant placement: human progress study. Implant Dent. 2008;17(1):82-90. [ Links ]
32. Velardi F, Amante PR, Caniglia M, De Rossi G, Gaglini P, Isacchi G, et al. Osteogenesis induced by autologous bone marrow cells transplant in the pediatric skull. Childs Nerv Syst. 2006;22(9):1158-66. [ Links ]
33. Xie H, Yang F, Deng L, Luo J, Qin T, Li X, et al. The performance of a bone-derived scaffold material in the repair of critical bone defects in a rhesus monkey model. Biomaterials. 2007;28(22):3314-24. [ Links ]
34. Yamada Y, Ueda M, Hibi H, Baba S. A novel approach to periodontal tissue regeneration with mesenchymal stem cells and platelet-rich plasma using tissue engineering technology: A clinical case report. Int J Periodontics Restorative Dent. 2006;26(4):363-9. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
Igor Iuco Castro-Silva
Laboratório de Bioengenharia, Biomateriais e Mineralização Biológica
Hospital Universitário Antônio Pedro
Rua Marquês do Paraná, 303 - 4º. andar - Emergência - Unidade de Pesquisa Clínica
24033-900 - Niterói - Rio de Janeiro - Brasil
E-mail: igoriuco@gmail.com
Recebido: 19/07/2010
Aceito: 08/11/2010













