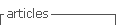Services on Demand
Article
Related links
Share
Innovations Implant Journal
On-line version ISSN 1984-5960
Innov. Implant. J., Biomater. Esthet. (Online) vol.5 n.1 São Paulo Jan./Apr. 2010
ARTIGOS CIENTÍFICOS
Avaliação multiparamétrica da citotoxicidade in vitro de um fio ortodôntico à base de resina polimérica reforçada com fibra de vidro
Multiparametric cytotoxicity in vitro evaluation of a glass fiber-reinforced composite orthodontic archwire
Fernando de Abreu-PereiraI; Gutemberg Gomes AlvesII; Letícia de Oliveira CastroIII; Adriana Brandão Ribeiro LinharesIV; Mônica Diuana Calasans MaiaV; José Mauro GranjeiroVI; José de Albuquerque Calasans-MaiaVII
IEspecialista em Ortodontia, Núcleo de Terapia Celular, Universidade Federal Fluminense, Niterói, RJ, Brasil
IIDoutor em Química Biológica. Professor Adjunto do Departamento de Biologia Celular e Molecular e Núcleo de Terapia Celular, Unidade de Pesquisa Clínica, Universidade Federal Fluminense, Niterói, RJ, Brasil
IIIGraduanda em Química. Estagiária de Iniciação Científica, Núcleo de Terapia Celular, Universidade Federal Fluminense, Niterói, RJ, Brasil
IVPós-Doutoranda, Universidade Federal Fluminense, Niterói, RJ, Brasil
VDoutora em Patologia. Professora da Disciplina de Cirurgia Bucal, Departamento de Odontoclínica, Universidade Federal Fluminense, Niterói, RJ, Brasil
VIProfessor Adjunto do Departamento de Biologia Celular e Molecular, Instituto de Biologia, Universidade Federal Fluminense, Niterói, RJ, Brasil. Professor Visitante da Faculdade de Odontologia de Bauru, Universidade de São Paulo, Bauru, SP, Brasil
VIIDoutor em Odontologia. Professor Adjunto da Faculdade de Odontologia, Universidade Federal Fluminense, Niterói, RJ, Brasil
RESUMO
O objetivo deste trabalho é avaliar a citotoxicidade dos fios ortodônticos estéticos feitos à base de resina polimérica reforçada com fibras de vidro, por três diferentes parâmetros de viabilidade celular. Foram preparados, de acordo com normas internacionais, extratos de amostras do fio Optis® Preformed Archwire intactos ou multiseccionados (em seções de 10 mm) e, como referência, fios de aço inoxidável do mesmo fabricante. Fenol a 2% e poliestireno denso foram utilizados como controle negativo e positivo respectivamente. Células de fibroblastos de camundongo da linhagem Balb/c-3T3 foram expostas por 24 horas a esses extratos, e a viabilidade celular foi identificada por três parâmetros: atividade mitocondrial, a partir do método do XTT, integridade membranar, pela captação do corante vermelho neutro e densidade celular, por meio do teste de exclusão do corante cristal violeta. Os extratos dos fios (aço inoxidável e fio em resina reforçada por fibra de vidro) foram compatíveis com altos índices de viabilidade celular medido através dos três diferentes parâmetros, sem diferenças estatísticas significativas entre os grupos. O processamento do fio estético em pequenas secções não alterou sua biocompatibilidade medida pelos mesmos métodos, indicando não haver diferença de toxicidade entre sua face externa de resina e seu interior reforçado em fibra de vidro. De acordo com os parâmetros avaliados, o fio estético não apresentou citotoxicidade, similar ao aço inoxidável já em largo uso ortodôntico. No entanto, novos parâmetros devem ser investigados para validá-lo, tanto com relação a aspectos biológicos como a aspectos físicos mais relacionados à sua eficiência na ortodontia.
Palavras-chave: Fios ortodônticos. Estética dentária. Ortodontia.
ABSTRACT
The purpose of this paper is evaluate the cytotoxicity of orthodontic archwires on polymeric resin reinforced with glass fiber, by three different cell viability parameters. According to international standards, extract samples of Optis® Preformed Archwire, both intact and sectioned into 10 mm pieces and, as reference, of stainless steel archwires, form the same manufacturer. 2% phenol and dense polystyrene were employed as a positive and negative control respectively. Balb/c-3T3 mouse fibroblasts were exposed by 24 hours to the extracts and cell viability was assayed by three parameters: mitochondrial activity (XTT), membrane integrity, measured by Neutral red uptake, and cell density as measured by the Violet Crystal dye exclusion test. Both archwires (stainless steel and fiber glass reinforced resin) were consisted with high levels of cell viability as measured by the three tests, without significative statistical differences among groups. Wire processing by cutting into little sections did not change biocompatibility as measured by the same methods, suggesting that there is no difference between the resin external face and the internal glass fiber reinforced interior. According to the evaluated parameters, the esthetic archwire does not presented cytotoxicity levels, similar to those obtained with a material widely employed in orthodontics. However, other parameters should be investigated in order to validate this material, both related to biological aspects, as well as physical characteristics more associated to its efficacy in orthodontics.
Key words: Orthodontic wires. Esthetics, dental. Orthodontics.
INTRODUÇÃO
Pacientes de ortodontia, em muitos casos, questionam sobre a sua própria aparência quando há necessidade de serem submetidos à terapia ortodôntica. Na tentativa de minimizar as exigências estéticas durante o tratamento ortodôntico, a indústria vem introduzindo diversos acessórios estéticos, fabricados por diferentes processos, todos com o fim de diminuir o impacto do tratamento sobre a aparência do paciente10. De fato, a estética tem se tornado um elemento importante no momento da escolha dos aparelhos ortodônticos fixos, principalmente quando o tratamento é executado em pacientes adultos. Embora a maioria dos acessórios utilizados atualmente na terapia ortodôntica é feita de aço inoxidável, com propriedades físicas apropriadas e boa compatibilidade biológica13, estes fios não satisfazem tais aspectos estéticos, esperados pela maioria dos pacientes. Compósitos dentários, por outro lado, são esteticamente agradáveis, uma vez que possuem aparência similar aos dentes, são estáveis no ambiente bucal e são relativamente fáceis de manusear8.
O desenvolvimento destes novos compósitos decorre de rápidos avanços na tecnologia de materiais, com grande impulso na ortodontia moderna, permitindo a escolha de materiais com propriedades físico-químicas, biológicas e estéticas mais apropriadas. No entanto, antes do lançamento de novos dispositivos ortodônticos, deve-se considerar os potenciais riscos de seu uso para a saúde do paciente15.
A biocompatibilidade dos materiais dentários tem sido motivo de estudos, e depende de diversos fatores relacionados à sua composição e utilização4. Os tipos de ligas usadas na ortodontia, por exemplo, diferem em sua composição e em suas propriedades físicas; no ambiente úmido da cavidade bucal, diversos destes materiais ortodônticos estão sujeitos a processos corrosivos, podendo ocorrer a liberação de substâncias tóxicas15,17,20. Em odontologia, onde vários materiais mantêm contato direto com os tecidos bucais por longo período de tempo, os fios ortodônticos, que estão entre esses materiais, podem oferecer riscos aos pacientes9,14,22.
Dentre os critérios de avaliação da biocompatibilidade de um novo material odontológico, preconizados por normas e padrões internacionais7, encontra-se a determinação de o quanto este pode ser tóxico para células em contato direto ou nas proximidades do material (citotoxicidade). Ensaios in vitro de citotoxicidade são, portanto, etapas necessárias no cenário de novos materiais para utilização in vivo.
Não existem até a presente data, no entanto, trabalhos avaliando a citotoxicidade ou mesmo outros parâmetros de biocompatibilidade dos fios ortodônticos estéticos compostos em fibra de vidro, talvez em decorrência do lançamento relativamente recente dos mesmos. Em vista disso, este trabalho teve como objetivo avaliar a citotoxicidade de fios ortodônticos estéticos feitos de resina polimérica reforçada com fibras de vidro - Optis® Preformed Archwire (TP Orthodontics, Inc., La Porte, IN, Estados Unidos) a partir de um sistema multiparamétrico, onde três diferentes parâmetros de citotoxicidade (atividade mitocondrial, integridade membranar e densidade de células) são investigados na mesma amostra. Como material de referência, utilizamos fios ortodônticos em aço inoxidável (TP Orthodontics, Inc., La Porte, IN, Estados Unidos).
MATERIAL E MÉTODOS
AMOSTRAS
O fio Optis® Preformed Archwire (TP Orthodontics, Inc., La Porte, IN, Estados Unidos) e o fio ortodôntico em aço inoxidável (TP Orthodontics, Inc., La Porte, IN, Estados Unidos), foram obtidos comercialmente. Os materiais foram esterilizados em autoclave, de acordo com as instruções do fabricante. Sendo o fio Optis® um material composto (resina reforçada com fibra de vidro), podendo apresentar citotoxicidade diferenciada em suas porções mais internas e externas. As amostras foram divididas em três grupos experimentais: Grupo 1, o fio Optis® foi mantido intacto, preservando sua estrutura; no Grupo 2, o fio Optis® foi seccionado em 32 segmentos de aproximadamente 10 mm cada, de maneira a expor o reforço em fibra de vidro; e o Grupo 3, fio de aço inoxidável, secção circular 0,022"; e dois grupos controles. Como controle negativo de citotoxicidade foram utilizadas pérolas densas de poliestireno, material considerado altamente biocompatível e, como controle positivo, fenol a 2% em meio de cultura DMEM.
PREPARO DOS EXTRATOS
Os extratos para o teste foram preparados de acordo com as normas ISO 7405:200811. Após esterilização, todos os fios, assim como o poliestireno, foram imersos em meio de cultura DMEM, na mesma proporção de 1 mg para cada 1 µL. Após 24 horas de exposição, os materiais foram removidos e os extratos assim obtidos foram utilizados para os testes de citotoxicidade.
CULTURA DE CÉLULAS
Para o teste foram utilizados fibroblastos de camundongo da linhagem Balbc/c-3T3 clone A31 CCL 163.2 da coleção da Unidade de Pesquisas Clínicas do Hospital Universitário Antônio Pedro, da Universidade Federal Fluminense (UFF). As células, mantidas a 37º C e 5% CO2 em meio de cultura DMEM de Alta Glicose (CULTILAB, Brasil) suplementado com 10% de Soro Fetal Bovino (SFB), foram transferidas para placas de cultura de 96 poços, na densidade de 8,5 x 103 células/cm2. As placas foram incubadas em DMEM a 37º C e 5% CO2 e, ao fim de 24 horas, o meio de cultura foi removido e substituído por 180 µL dos respectivos extratos preparados a partir das amostras e controles adicionado de SFB 10%, obtendo-se assim 5 réplicas de cada condição experimental. Um grupo de células (controle de células) foi exposto apenas ao meio de cultura DMEM contendo SFB 10%.
ENSAIO DE CITOTOXICIDADE
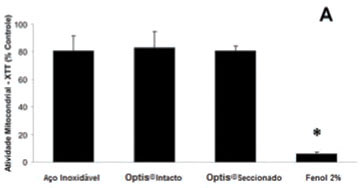
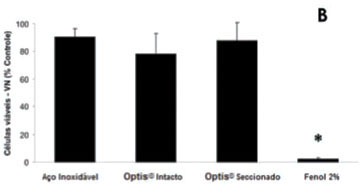
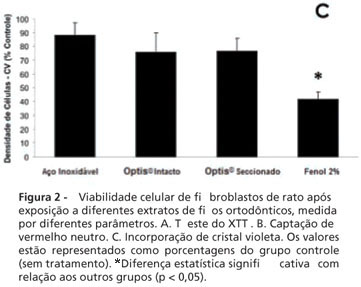
A citotoxicidade foi avaliada de acordo com trabalhos anteriores3, a partir de um método multiparamétrico, utilizando o kit In Cytotox® (Xenometrix Inc., Allschwil, Suíça). Este método permite a avaliação de 3 diferentes parâmetros de sobrevivência e integridade celular ao mesmo tempo (XTT, vermelho neutro e cristal violeta). O teste do XTT baseia-se na habilidade de enzimas mitocondriais de converterem sais solúveis de tetrazolium em compostos solúveis de formazano, medidos por sua absorbância a 480 nm em um leitor de microplacas UV/Vis (Synergy II, BioTek Instruments, Winooski, VT, Estados Unidos). O vermelho neutro (VN) é um teste de viabilidade celular baseado na habilidade de células com membranas intactas de incorporar e reter o corante vermelho neutro em seus lisossomos; a quantidade de corante incorporado pode ser medida, após extração, por sua absorbância a 540 nm. O teste de exclusão do cristal violeta (CV) é um ensaio simples que avalia a densidade de células em um poço ao marcar seu DNA, após tratamento e lavagem do excesso de corante, sendo a absorbância a 540 nm equivalente à quantidade de células no poço.
ANÁLISE ESTATÍSTICA
A análise estatística foi realizada com o auxílio do programa InStat® 3.01 (GraphPad software, San Diego, CA, Estados Unidos). As médias dos valores e desvios padrão foram calculados e verificados com relação à sua distribuição normal (teste de D'Agostino). Um teste de análise de variância não paramétrica (Kruskal-Wallis, pós-teste de Dunn) foi realizado e as diferenças foram consideradas significativas se p < 0,05.
RESULTADOS
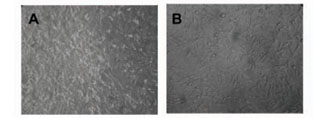
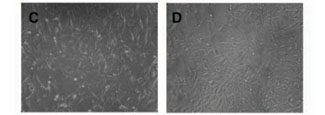
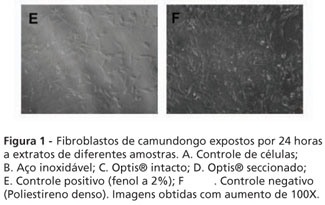
A Figura 1 apresenta a distribuição e o aspecto geral dos fibroblastos de camundongo após 24 horas de exposição aos diferentes extratos e ao meio de cultura (controle de células). Na Figura 1A, que representa o controle de células, podemos observar que estas se encontram em estado de sub-confluência, muito semelhante ao observado no controle negativo (poliestireno, Figura 1F). Nenhuma alteração foi notada na forma característica deste tipo celular entre os grupos tratados com os fios (Figuras 1B - aço inoxidável, 1C - Optis® intacto e 1D – Optis® seccionado), Enquanto todos os tratamentos pareceram visualmente apresentar densidades de células superiores às do controle positivo (fenol a 2%), ainda que certa quantidade de células possa ser visualizada mesmo após o tratamento com esta substância tóxica (Figura 1E).
Na Figura 2, são apresentados os resultados para o teste de citotoxicidade, sendo a sobrevivência nos diferentes grupos representada como porcentagens do grupo controle de células (sem tratamento). O poliestireno, usado como controle negativo, apresentou índices de viabilidade celular compatíveis com o controle nos três testes, e não é apresentado na Figura 2. Na Figura 2A, podemos observar que o fenol a 2% foi capaz de afetar a atividade mitocondrial medida pelo método do XTT em aproximadamente 95%, indicando sua toxicidade. Todos os outros grupos, no entanto, apresentaram mais de 70% de sobrevivência, sem diferença estatística significativa entre os mesmos. Na Figura 2B, curiosamente, o teste do vermelho neutro apresentou uma aparente menor porcentagem de células íntegras no Optis® intacto, sem, no entanto, haver diferença significativa com os dois outros grupos (Optis® seccionado e fio de aço). A densidade celular medida pela exclusão de cristal violeta (Figura 2C) também não foi estatisticamente significativa entre os diferentes fios (aço, Optis® intacto e Optis® seccionado). Curiosamente, observamos uma inesperada alta densidade de células medida no grupo controle positivo (Fenol 2%), correspondendo a 40% do controle, em contraste com os mais de 95% morte celular detectados pelos dois outros métodos.
DISCUSSÃO
Ainda que haja normas e padrões internacionais no teste e uso de novos materiais, a biocompatibilidade de muitos materiais ortodônticos usados rotineiramente, os quais podem causar efeitos adversos em situações clínicas, é muitas vezes questionada16. Apesar de avaliações prévias realizadas pelos próprios fabricantes, outras investigações dos efeitos biológicos in vitro e in vivo dos materiais são obtidas por meio de pesquisa científica após seu lançamento, na medida em que surgem novas técnicas, metodologias e parâmetros de avaliação.
Neste trabalho, apresentamos a avaliação da citotoxicidade de um material ortodôntico relativamente novo e pouco estudado, a saber, os fios ortodônticos estéticos feitos à base de resina polimérica reforçada com fibras de vidro (Optis®), utilizando fios de aço inoxidável, mais comumente aplicados na ortodontia, como referencial de qualidade. Nosso estudo preliminar, a partir da análise de três parâmetros de viabilidade celular, não foi capaz de encontrar diferenças significativas entre os dois tipos de fios. Ainda, determinamos que o processamento do fio estético por meio de diversas secções de modo a expor a superfície interna do material, não gera impacto nos parâmetros de viabilidade estudados. Todos os grupos experimentais apresentaram índices de viabilidade celular inferiores ao controle de células, mas permaneceram acima de 70%, o que seria não citotóxico dentro de padrões aceitos na Europa19 – na ausência de um referencial nacional. Estes resultados estão também em concordância com os resultados de outros trabalhos, onde compósitos de resinas reforçados com fibra de vidro aplicados a outras áreas da odontologia (prótese dentária e dentística) foram descritos como materiais adequados e com boa biocompatibilidade12,21. Além disso, em condições in vivo, os níveis de compatibilidade aqui encontrados seriam ainda maiores, seja devido à rápida ciclagem de líquidos no espaço bucal, seja devido à queratina e outras proteções das células da mucosa18.
Diversas técnicas podem ser empregadas na avaliação da citotoxicidade in vitro em materiais odontológicos11. Neste trabalho, no entanto, uma das vantagens da metodologia é o fato de que, para um mesmo grupo de células tratadas, pudemos avaliar três diferentes parâmetros. A relevância desta diferença aparece quando consideramos que, muitas vezes, os resultados obtidos apenas com um método podem ser super ou subestimados, devido a interferências ou limitações metodológicas. Trabalhos prévios mostraram conflitos entre os resultados obtidos com o XTT e outros parâmetros1-3. Neste trabalho, pudemos observar que, a despeito da queda na atividade mitocondrial e integridade membranar observados no grupo controle positivo (Figura 1E), parte das células ainda não perdeu aderência e seu material nucléico, causando a presença de células detectadas tanto pelo cristal violeta quanto pela observação por microscópio invertido (Figura 1E). Neste caso, enquanto o método do cristal violeta permanece adequado para a determinação do grau de adesão de células, sua utilização isolada não seria suficiente para a determinação da viabilidade celular, altamente reduzida pelo fenol a 2%, como mostrado pelos métodos do XTT e vermelho neutro.
CONCLUSÃO
Deste modo, podemos concluir que, de acordo com os dados aqui apresentados, diferentes parâmetros de viabilidade celular apontam para uma biocompatibilidade similar entre os dois tipos de fios, ambos acima de níveis internacionalmente aceitos. No entanto, sabe-se que inúmeros outros parâmetros além da citotoxicidade podem e devem ser investigados antes da validação de um material, tais como genotoxicidade, capacidade de gerar processos inflamatórios e estudos in vivo. Além disso, outras características inerentes à eficiência dos materiais ortodônticos além da biocompatibilidade devem ser levadas em conta por profissionais e pacientes na escolha do material adequado. Estas características, que devem ser preservadas nos novos materiais estéticos, de modo a não comprometer a qualidade do tratamento, estão muito mais ligadas a aspectos estruturais e físicos3,5,23-25, e devem ser objeto de pesquisa científica nos próximos anos.
AGRADECIMENTOS
Agradecemos à FAPERJ, MS/DECIT, CNPq e FINEP pelo apoio financeiro.
REFERÊNCIAS
1. Castro-Silva II, Alves GG, Castro LO, Ramirez CM, Granjeiro JM. Estudo preliminar da influência do laser de baixa intensidade (GaAIAs) na proliferação de células derivadas de polpa dental decídua humana. Innov Implant J, Biomater Esthet. 2009;4(2):48-52. [ Links ]
2. Chiba K, Kawakami K, Tohyama K. Simultaneous evaluation of cell viability by neutral red, MTT and crystal violet staining assays of the same cells. Toxicology in vitro. 1998;12(3):251-8. [ Links ]
3. De Deus G, Canabarro A, Alves G, Linhares A, Senne MI, Granjeiro JM. Optimal cytocompatibility of a bioceramic nanoparticulate cement in primary human mesenchymal cells. J Endod. 2009;35(10):1387-90. [ Links ]
4. Eliades T. Orthodontic materials research and applications: part 2. Current status and projected future developments in materials and biocompatibility. Am J Orthod Dentofacial Orthop. 2007;131(2):253-62. [ Links ]
5. Fallis DW, Kusy RP. Variation in flexural properties of photo-pultruded composite archwires: analyses of round and rectangular profiles. J Mater Sci Mater Med. 2000;11(11):683-93. [ Links ]
6. Huang ZM, Gopal R, Fujihara K, Ramakrishna S, Loh PL, Foong WC, et al. Fabrication of a new composite orthodontic archwire and validation by a bridging micromechanics model. Biomaterials. 2003;24(17):2941-53. [ Links ]
7. International Organization for Standardization. ISO 7405: dentistry - preclinical evaluation of biocompatibility of medical devices used in dentistry - test methods for dental materials. Geneva: The Organization; 2008. [ Links ]
8. Jandt KD, Sigusch BW. Future perspectives of resin-based dental materials. Dent Mater. 2009;25(8):1001-6. [ Links ]
9. Kao CT, Ding SJ, He H, Chou MY, Huang TH. Cytotoxicity of orthodontic wire corroded in fluoride solution in vitro. Angle Orthod. 2007;77(2):349-54. [ Links ]
10. Kusy RP. A review of contemporary archwires: their properties and characteristics. Angle Orthod. 1997;67(3):197-207. [ Links ]
11. Matta ENR, Calasans-Maia JA, Ruellas ACO, Wigg MD. Avaliação da citotoxicidade in vitro de elásticos ortodônticos com tratamento de superfície. J Bras Ortodon Ortop Facial. 2004;9(54):587-93. [ Links ]
12. Meric G, Dahl JE, Ruyter IE. Cytotoxicity of silica-glass fiber reinforced composites. Dent Mater. 2008;24(9):1201-6. [ Links ]
13. Oh KT, Choo SU, Kim KM, Kim KN. A stainless steel bracket for orthodontic application. Eur J Orthod. 2005;27(3):237-44. [ Links ]
14. Oh KT, Kim KN. Ion release and cytotoxicity of stainless steel wires. Eur J Orthod. 2005;27(6):533-40. [ Links ]
15. Rose EC, Jonas IE, Kappert HF. in vitro investigation into the biological assessment of orthodontic wires. J Orofac Orthop. 1998;59(5):253-64. [ Links ]
16. Schmalz G. Biological evaluation of medical devices - a review of EU regulations, with emphasis on in-vitro screening for biocompatibility. Altern Lab Anim. 1995;23(4):469-73. [ Links ]
17. Shih CC, Lin SJ, Chen YL, Su YY, Lai ST, Wu GJ, et al. The cytotoxicity of corrosion products of nitinol stent wire on cultured smooth muscle cells. J Biomed Mater Res. 2000;52(2):395-403. [ Links ]
18. Sjogren G, Sletten G, Dahl JE. Cytotoxicity of dental alloys, metals, and ceramics assessed by millipore filter, agar overlay, and MTT tests. J Prosthet Dent. 2000;84(2):229-36. [ Links ]
19. Spielmann H, Hoffmann S, Liebsch M, Botham P, Fentem JH, Eskes C, et al. The ECVAM international validation study on in vitro tests for acute skin irritation: report on the validity of the EPISKIN and EpiDerm assays and on the Skin Integrity Function Test. Altern Lab Anim. 2007;35(6):559-601. [ Links ]
20. Tomakidi P, Koke U, Kern R, Erdinger L, Kruger H, Kohl A, et al. Assessment of acute cyto- and genotoxicity of corrosion eluates obtained from orthodontic materials using monolayer cultures of immortalized human gingival keratinocytes. J Orofac Orthop. 2000;61(1):2-19. [ Links ]
21. Vallittu PK, Ekstrand K. in vitro cytotoxicity of fibre-polymethyl methacrylate composite used in dentures. J Oral Rehabil. 1999;26(8):666-71. [ Links ]
22. Vande Vannet BM, Hanssens JL. Cytotoxicity of two bonding adhesives assessed by three-dimensional cell culture. Angle Orthod. 2007;77(4):716-22. [ Links ]
23. Zufall SW, Kennedy KC, Kusy RP. Frictional characteristics of composite orthodontic archwires against stainless steel and ceramic brackets in the passive and active configurations. J Mater Sci Mater Med. 1998;9(11):611-20. [ Links ]
24. Zufall SW, Kusy RP. Sliding mechanics of coated composite wires and the development of an engineering model for binding. Angle Orthod. 2000;70(1):34-47. [ Links ]
25. Zufall SW, Kusy RP. Stress relaxation and recovery behaviour of composite orthodontic archwires in bending. Eur J Orthod. 2000;22(1):1-12. [ Links ]
 Endereço para correspondência:
Endereço para correspondência:
José de Albuquerque Calasans-Maia
Rua Dr. Silvio Henrique Braune 22 - Centro
28625-650 - Nova Friburgo – Rio de Janeiro – Brasil
E-mail: josecalasans@vm.uff.br
Recebido: 19/02/2010
Aceito: 26/03/2010