Services on Demand
Article
Related links
Share
Revista da Associacao Paulista de Cirurgioes Dentistas
Print version ISSN 0004-5276
Rev. Assoc. Paul. Cir. Dent. vol.68 n.2 Sao Paulo Apr./Jun. 2014
Efeito citotóxico dos cimentos de ionômero de vidro em cultura celular
Cytotoxic effect of glass ionomer cements in cell culture
Ana Carolina Costa da Mota I; Lara Jansiski Motta II; Elaine Marcílio Santos III; Carolina Cardoso Guedes IV; Thays Almeida Alfaya V; Sandra Kalil Bussadori VI
I Graduação em Odontologia pela Universidade de São Paulo (USP) - Mestrado em Biofotônica
II Doutora em Ciências da Saúde pela USP - Professora da Graduação em Odontologia da Universidade Nove de Julho (Uninove)
III Doutora em Odontopediatria pela USP - Professora da Graduação em Odontologia da Universidade Camilo Castelo Branco (Unicastelo)
IV Mestre em Pediatria e Ciências Aplicadas à Pediatria pela USP - Professora da Graduação em Odontologia da Universidade Braz Cubas
V Mestre em Odontologia (Clínica Odontológica) pela Universidade Federal Fluminense (UFF)
VI Pós-Doutora em Ciências pela USP - Professora do Programa de Mestrado/Doutorado em Ciências da Reabilitação da Universidade Nove de Julho e da Especialização em Odontopediatria da APCD Central
RESUMO
Objetivo: Avaliar a toxicidade de cimentos de ionômero de vidro (CIV) quimicamente ativados em culturas de células, após aglutinação do material e reação de presa. Materiais e Métodos: Dividiu-se os materiais em 9 grupos experimentais: I: controle, II (AP) Riva Self Cure (SDI), III (PP) Riva Self Cure (SDI), IV (AP) Maxxion R (FGM), V (PP) Maxxion (FGM), VI (AP) Vitro Molar (DFL), VII (PP) Vitro Molar (DFL), VIII (AP) KetacMolar Easymix, IX (PP) Ketac Molar Easymix (3M/ESPE). Manipularam-se os CIV conforme instruções do fabricante sendo depositados em lamínulas em contato com a cultura de células logo após a aglutinação do material e após a reação de presa. A ação dos materiais sobre os fibroblastos cultivados foi analisada sobre o crescimento celular no curto, longo prazo e no ensaio de viabilidade e proliferação celular. Resultados: Grupos que receberam materiais após a presa apresentaram número de células viáveis e porcentagens menores que o grupo controle, porém permitiram crescimento celular durante todo experimento. Quando colocados em contato com as células logo após a aglutinação, induziram morte celular imediata. O material que demonstrou menor atividade citotóxica em fibroblastos foi o Ketac- Molar Easymix (3M/ESPE). Conclusão: Todos os CIV testados apresentaram-se tóxicos antes da reação de presa, entretanto após a reação de presa, permitiram crescimento celular.
Palavras-chave: testes de toxicidade; cimentos de ionômeros de vidro; técnicas de cultura de células
ABSTRACT
Aim: The aim of the present study was to assess the toxicity of different chemically activated GICs in fibroblast cell cultures post-agglutination (PA) and post-setting reaction (PS). Material and Methods: The materials were divided into nine experimental groups: Group I - control; Group II (PA) - Riva Self Cure (SDI); Group III (PS) - Riva Self Cure (SDI); Group IV (PA) - Maxxion R (FGM); Group V (PS) - Maxxion (FGM); Group VI (PA) - Vitro Molar (DFL); Group VII (PS) - Vitro Molar (DFL); VIII (PA) - Ketac Molar Easymix; and Group IX (PS) - Ketac Molar Easymix (3M/ ESPE). The cements were mixed following the manufacturers' instructions, deposited on glass slip covers and placed into contact with the cell cultures immediately following the agglutination of the material or after the setting reaction. The effect of the materials on the cultivated fibroblasts was analyzed in terms of short-term and long-term cell growth as well as in viability and cell proliferation assays. Results: When placed in contact with the cells immediately following agglutination, the materials caused immediate cell death. The groups having received the materials following the setting reaction had a lower number and percentage of viable cells in comparison to the control, but the materials allowed cell growth throughout the experiment. KetacMolar Easymix (3M/ESPE) was the glass ionomer cement with the least amount of cytotoxic activity on fibroblasts. Conclusion: All glass ionomer cements tested were toxic prior to the setting reaction.However after setting reaction, allowed cell growth.
Keywords: glass ionomer cements; cytotoxicity tests, immunologic; cell culture techniques
RELEVÂNCIA CLÍNICA
Conhecer a toxicidade dos materiais é de grande importância na clínica odontológica rotineira. Antes de iniciar qualquer procedimento restaurador, é importante que o profissional selecione os materiais que irão apresentar comportamento mais adequado diante do caso clínico em questão. Atenção deve ser dada não apenas as características do material quanto ao tempo de trabalho e manuseio, mas também aos possíveis efeitos citotóxicos que eles podem causar à mucosa oral e dentes.
INTRODUÇÃO
O cimento de ionômero de vidro (CIV) é um material oxirresinoso que apresenta como característica principal uma reação ácido-base na presença de um ácido polialcenoico ionizável, conferindo sua reação de presa.1
O GIC foi desenvolvido na década de 70 por Wilson e Kent2 e têm sido largamente recomendado para o Tratamento Restaurador Atraumático (ART), selamento e remoção química e mecânica da lesão de cárie devido às suas propriedades físicas, como adesividade à estrutura dental, biocompatibilidade e liberação de íons flúor.3 Por ser utilizado em grande escala, principalmente no âmbito de saúde pública e promoção de saúde, o CIV vem sendo constantemente estudado e sofrendo modificações em sua formulação inicial visando uma melhora em suas propriedades físicas, químicas e mecânicas.4
O CIV apresenta diferentes propriedades, facilitando assim o procedimento clínico em uma fase de devolução de saúde, principalmente em lesões profundas de cárie e em pacientes com alta atividade da doença5. De acordo com a sua composição química, podem ser classificados como convencionais, reforçados por metais, alta viscosidade e modificados por resina. Segundo Costa et al. (2003), os CIV modificados por resina e de alta viscosidade apresentam potencial citotóxico em cultura de células de linhagem de odontoblastos (MDPC-23), resultando em efeito agressivo. Esta citotoxicidade é maior nos cimentos de ionômero de vidro modificados por resina do que nos convencionais de alta viscosidade e isso é atribuído à presença de monômeros hidrofílicos como o 2-hidroxietil-metacrilato (HEMA) na composição destes materiais.6,7 A alta concentração de Zn 2+ também tem sido relacionada ao efeito citotóxico.8
Este estudo tem por objetivo avaliar a toxicidade de diferentes cimentos de ionômero de vidro quimicamente ativados em culturas de células após a aglutinação do material (AP) e após reação de presa inicial (PP).
MATERIAIS E MÉTODOS
Os cimentos foram divididos em 9 grupos experimentais: Grupo I: controle, Grupo II (AP) Riva Self Cure (SDI), Grupo III (PP) Riva Self Cure (SDI), Grupo IV (AP) Maxxion R (FGM), Grupo V (PP) Maxxion (FGM), Grupo VI (AP) Vitro Molar (DFL), Grupo VII (PP) Vitro Molar (DFL), Grupo VIII (AP) Ketac Molar Easymix, Grupo IX (PP) Ketac Molar Easymix (3M/ESPE).
Os CIV foram manipulados de acordo com as instruções do fabricante e o cimento foi depositado em lamínulas em contato com a cultura de células logo após a aglutinação e após o tempo de presa. O grupo controle não recebeu nenhum tipo de material. A ação dos materiais sobre os fibroblastos cultivados foi analisada sobre o crescimento celular em curto e longo prazo, e no ensaio de viabilidade e proliferação celular.
Resposta celular imediata ou teste de curto prazo
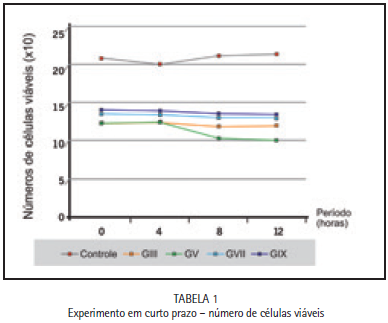
As células foram plaqueadas numa densidade de 1x104 células em placas de Petri de 60 mm de diâmetro, e depois de obtida a confluência (72 horas), depositadas em lamínulas de vidro de 15 mm contendo 0,06g dos diferentes cimentos de ionômero de vidro testados antes e após a reação de presa, sendo que as culturas controle receberam lamínulas de vidro sem material. Após 0, 4, 8 e 12 horas de contato com as substâncias, as células de 3 placas de Petri para cada período experimental foram tripsinizadas e contadas em câmaras de Neubauer, utilizando-se o método de exclusão de células coradas pelo azul de Trypan.
Crescimento celular ou teste de longo prazo
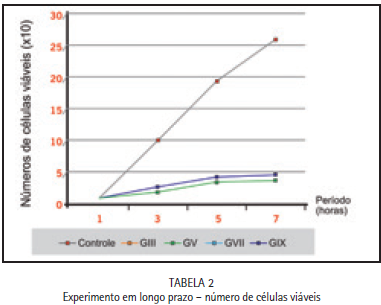
Nestes experimentos, os fibroblastos NIH-3T3, foram plaqueados em número de 1x104 células por placa de Petri de 60 mm de diâmetro, e 4 horas após o plaqueamento, tempo suficiente para a maioria das células aderirem à placa de Petri, lamínulas de vidro de 15 mm de diâmetro, contendo 0,06 g dos diferentes cimentos de ionômero de vidro, foram colocadas sobre os fibroblastos embrionários e as culturas controle receberam somente as lamínulas de vidro. A cada 2 dias os meios de cultivo das placas de Petri 50% foram removidos. Após 1, 3, 5 e 7 dias do contato com as substâncias, culturas em triplicatas, tiveram suas células tripsinizadas e contadas em câmaras de Neubauer, utilizando-se o método de exclusão de células coradas pelo azul de Trypan (Freshney, 1990).
Ensaio de viabilidade e proliferação celular (métodos MTT e cristal violeta)
Para determinar a viabilidade utilizou-se uma técnica indireta (MTT). Após aglutinação do material e após reação de presa colocou-se os cimentos de ionômero de vidro em um tubo de ensaio onde foi aplicado 1,1 mL de meio de cultura sem soro fetal bovino (DMM-SFB). Após 24h de manutenção dos materiais imersos em DMEM-SFB, esta solução contendo os materiais liberados foram colocados diretamente sobre as células NIH-3T3. Os fibroblastos (1X104/poço) foram incubados em placas de cultura de fundo chato de 96 poços (TPP, Suiça) mantidos em DMEM (5% de soro fetal bovino). A proliferação e viabilidade celular foram avaliadas após 24 de incubação. Assim, após 24h de cultivo foi realizada lavagem com 200 ml de PBS 1X. Em seguida, foram adicionados 50 ml de MTT (0,5 mg/ml em tampão) (3-[4,5-Dimethylthiazol- 2yl]-2,5-diphenyltetrazolium bromide; Thiazolyl blue – SIGMA) e realizada uma incubação de 3h a 37oC em estufa de CO2. Terminado o tempo de incubação, a solução foi removida, e adicionados 100 ml de isopropanol para ressuspender e solubilizar o precipitado. Para avaliação da viabilidade celular empregou-se a espectrofotometria no leitor Universal de ELISA (ELX 800- Universal Microplate Reader- BIO-TEK Instruments, ICC,USA), em um comprimento de onda de 570 nm.
Os dados numéricos foram analisados pelo teste estatístico de Kruskal-Wallis, considerando um nível de significância de 5%.Para a análise dos resultados desses dados foram utilizados média, desvio padrão e análise de variância (ANOVA) com auxílio do software "GraphPad InStat-3". A significância estatística foi verificada pelo teste Dunnett e considerada aceitável quando p£0.05.
RESULTADOS
Crescimento e viabilidade celular
Os resultados obtidos no curto e longo prazo dos cimentos de ionômero de vidro testados nos diferentes momentos (AP e PP) demonstraram que no período antes da presa (AP) todos os cimentos de ionômero de vidro promoveram morte celular imediata. Nos experimentos de curto prazo, observou-se que ao contato imediato dos materiais no período após a reação de presa inicial (PP) houve uma diminuição do número de células viáveis (Figura 1) e a partir do período de 4h, observou-se que não houve redução na viabilidade celular, apenas com o grupo IV, conforme evidenciado na Figura 2.
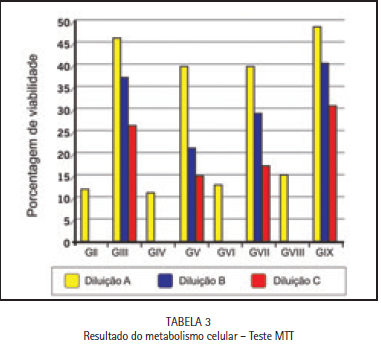
Metabolismo celular (Teste MTT)
Os valores numéricos obtidos por meio da análise realizada no leitor de ELISA para três alíquotas de cada amostra demostraram uma média da atividade mitocondrial (metabolismo celular) para a mesma. A média das 5 amostras determinou o metabolismo celular frente à exposição ao extrato de cada um dos cimentos de ionômero de vidro estudados.
Os resultados mostraram que os grupos que receberam materiais após a presa apresentaram número de células viáveis e porcentagens menores que o grupo controle, porém permitiram crescimento celular durante todo experimento. Quando colocados em contato com as células logo após a aglutinação, induziram morte celular imediata. O material que demonstrou menor atividade citotóxica em fibroblastos foi o KetacMolar Easymix (3M).
DISCUSSÃO
Estudos investigam as reações do CIV sobre os tecidos dentários. Sua biocompatibilidade tem sido confirmada em tecidos pulpares.9,10 Testes em cultura de células são empregados para observar a agressão que os materiais odontológicos podem proporcionar.11 Assim, como o presente estudo, outros pesquisadores avaliaram os efeitos tóxicos desse produto12,13, ressaltando os nossos achados. Grupos que receberam materiais após o tempo de presa apresentaram número de células viáveis em porcentagens menores que o grupo controle, porém permitiram crescimento celular durante todo experimento. Após a reação de presa dos materiais houve a redução da citotoxicidade em cultura de fibroblastos e o material que demonstrou menor atividade citotóxica em fibroblastos foi o Ketac Molar Easymix (3M/ESPE).
Componentes de resina proporcionam ao CIV características relativas à menor sensibilidade à umidade, maior resistência mecânica e melhores condições de manuseio e trabalho. A adição do HEMA tem sido considerada como responsável pela citotoxidade do material6,7, em virtude do peso molecular baixo do monômero podendo se espalhar rapidamente pelos fluidos orais.14 A reação de toxicidade ocorre com a difusão de componentes presentes nos materiais odontológicos pelos túbulos dentinários15, levando
a processo inflamatório crônico mediado por macrófagos e células gigantes, com a ocorrência de degradação do tecido pulpar, associada a reabsorções dentárias internas.16,17
A presa dos cimentos de ionômeros de vidro modificados por resina se dá por meio de reação ácido-base, característica dos cimentos convencionais e pela polimerização do monômero resinoso que se inicia por ativação pela luz. Durante fase de inserção e após o tempo de presa do material por apresentar uma reação ácido-base logo no momento em que as matrizes estão se formando, poderia apresentar um comportamento tóxico em lesões profundas de cárie. Segundo alguns pesquisadores no intervalo entre essa duas fases ocorre aumento da temperatura, alteração do pH e liberação de íons e monômeros residuais.18,19
Stanislawski et al. (1999) compararam sete biomateriais (5 CIV modificados por resina, 1 CIV reforcado por metais and 1 zinc-oxyphosphatecement) utilizando o MTT. O CIV reforçado por metais e o Vitremer (3M/ESPE) foram o materiais que apresentaram maior toxicidade, que foi atribuída à presença de monómeros não polimerizados, tais como HEMA e TEGDMA, e ácidos poliacrílicos. No CIV reforçado por metais os principais elementos responsáveis pela toxicidade foram Cu2 + e Ag + presentes em concentrações tóxicas. Analisaram-se a citotoxicidade de outros íons, tais como F-, Al3 +, Zn2 + e Sr2+. O zinco foi o único componente que foi encontrado ser de uma concentração suficientemente elevada para induzir citotoxicidade. Estes elementos estavam presentes CIV reforçado por metais e pode ter contribuído para os resultados encontrados.20
Os efeitos citotóxicos sobre uma linha de células odontoblástica foi estudado por de Souza Costa et al (2003). Os pesquisadores analisaram o comportamento de cinco CIVs, convencionais e modificados por resina. Os CIVs convencionais foram menos citotóxicos e os modificados por resina tiveram efeitos intensos sobre as células cultivadas, com diminuição significativa do metabolismo da mesma e morte celular notável. Os efeitos citotóxicos elevados observados podem ter ocorrido por causa de monómeros que não reagem com a resina, já que outros compostos, tais como F-, Al3 +, Sr2 +, Zn2 + também estão presentes nos CIVs convencionais.8
Os cimentos de ionômero de vidro têm um papel muito importante na devolução de saúde do indivíduo, entretanto, todos os CIV testados apresentaram-se tóxicos antes da reação de polimerização. Após a reação de presa dos materiais houve a redução da citotoxicidade, permitindo o crescimento celular. Diante desse fato, ressalta-se que antes de iniciar qualquer procedimento restaurador, é importante que o profissional selecione os materiais que irão apresentar comportamento mais adequado diante do caso clínico em questão. Atenção deve ser dada não apenas as características do material quanto ao tempo de trabalho e manuseio, mas também aos possíveis efeitos citotóxicos que eles podem causar à mucosa oral e dentes.
CONCLUSÃO
Os grupos que receberam materiais após a reação de presa apresentaram número de células viáveis e porcentagens menores que o grupo controle, porém permitiram crescimento celular durante todo o experimento. Quando colocados em contato com células logo após a aglutinação, induziram a morte celular imediata. Todos os CIV testados apresentaram-se tóxicos antes da reação de presa.
APLICAÇÃO CLÍNICA
Conhecer a toxicidade dos materiais é de grande importância na clínica odontológica rotineira.
O Cirurgião-Dentista deve ter embasamento científico para a escolha do material a ser utilizado.
REFERÊNCIAS
1. Xie D, Brantley WA, Culbertson BM, Wang G. Mechanical properties and microstructures of glass-ionomer cements. Dent Mater 2000;16(2):129-38. [ Links ]
2. Wilson AD, Kent BE. The glass-ionomer cement, a new translucent dental filling material. J Appl Chem Biotecnol 1971;21(11):371.
3. Chadwick BL, Evans DJ. Restoration of class II cavities in primary molar teeth with conventional and resin modified glass ionomer cements: a systematic review of the literature. Eur Arch Paediatr Dent 2007;8(1):14-21.
4. Zoergiebel J, Ilie N. Evaluation of a conventional glass ionomer cement with new zinc formulation: effect of coating, aging and storage agents. Clin Oral Investig 2013 Mar;17(2):619-26.
5. Croll TP, Bar-Zion Y, Segura A, Donly KJ. Clinical performance of resin-modified glass ionomer cement restorations in primary teeth. A retrospective evaluation. J Am Dent Assoc 2001;132(8):1110-6.
6. Vermeersch G, Leloup G, Delmee M, Vreven J. Antibacterial activity of glass-ionomer cements, compomers and resin composites: relationship between acidity and material setting phase. J Oral Rehabil 2005;32(5):368-74.
7. Souza PP, Aranha AM, Hebling J, Giro EM, Costa CA. In vitro cytotoxicity and in vivo biocompatibility of contemporary resin-modified glass-ionomer cements. Dent Mater 2006;22(9):838-44.
8. de Souza Costa CA, Hebling J, Garcia-Godoy F, Hanks CT. In vitro cytotoxicity of five glass-ionomer cements. Biomaterials 2003;24(21):3853-8.
9. Nicholson JW, Czarnecka B. The biocompatibility of resin-modified glass-ionomer cements for dentistry. Dent Mater 2008;24(12):1702-8.
10. Garcia Lda F, Pires-de-Souza Fde C, Teofilo JM, Cestari A, Calefi PS, Ciuffi KJ, et al. Synthesis and biocompatibility of an experimental glass ionomer cement prepared by a non-hydrolytic sol-gel method. Braz Dent J 2010;21(6):499-07.
11. Cao T, Saw TY, Heng BC, Liu H, Yap AU, Ng ML. Comparison of different test models for the assessment of cytotoxicity of composite resins. J Appl Toxicol 2005;25(2):101-8.
12. Aranha AM, Giro EM, Souza PP, Hebling J, de Souza Costa CA. Effect of curing regime on the cytotoxicity of resin-modified glass-ionomer lining cements applied to an odontoblast- cell line. Dent Mater 2006;22(9):864-69.
13. Dos Santos RL, Pithon MM, Martins FO, Romanos MT, Ruellas AC. Evaluation of cytotoxicity and degree of conversion of glass ionomer cements reinforced with resin. Eur J Orthod 2011.
14. Xie D, Chung ID, Wu W, Mays J. Synthesis and evaluation of HEMA-free glass-ionomer cements for dental applications. Dent Mater 2004;20(5):470-8.
15. de Souza Costa CA, Lopes do Nascimento AB, Teixeira HM, Fontana UF. Response of human pulps capped with a self-etching adhesive system. Dent Mater 2001;17(3):230-40.
16. Costa CA, Giro EM, do Nascimento AB, Teixeira HM, Hebling J. Short-term evaluation of the pulpo-dentin complex response to a resin-modified glass-ionomer cement and a bonding agent applied in deep cavities. Dent Mater 2003;19(8):739-46.
17. do Nascimento AB, Fontana UF, Teixeira HM, Costa CA. Biocompatibility of a resin-modified glass-ionomer cement applied as pulp capping in human teeth. Am J Dent 2000;13(1):28-34.
18. Gerzina TM, Hume WR. Diffusion of monomers from bonding resin-resin composite combinations through dentine in vitro. J Dent 1996;24(1-2):125-8.
19. Kawai K, Takaoka T. Fluoride, hydrogen ion and HEMA release from light-cured GIC restoratives. Am J Dent 2002;15(3):149-52.
20. Stanislawski L, Daniau X, Lauti A, Goldberg M. Factors responsible for pulp cell cytotoxicity induced by resin-modified glass ionomer cements. J Biomed Mater Res 1999;48(3):277-88.
 Endereço para correspondência:
Endereço para correspondência:
Ana Carolina Costa da Mota
Rua Machado de Assis 822 – apt. 121
Vila Mariana – São Paulo - SP
04106000 - Brasil
e-mail: ana_cmota@yahoo.com.br
Recebido: mar/2014
Aceito: mai/2014