Services on Demand
Article
Related links
Share
RFO UPF
Print version ISSN 1413-4012
RFO UPF vol.17 n.2 Passo Fundo May./Aug. 2012
Ação antimicrobiana do hipoclorito de sódio a 2,5% e clorexidina gel 2% em raízes contaminadas com Enterococcus faecalis
Antimicrobial action of 2.5% sodium hypochlorite and 2% chlorhexidine gel in roots contaminated by Enterococcus faecalis
Tiago Lange dos Santos I; Eduardo DallMagro II; Alessandra Kuhn-Dall'Magro III; Bruna Corrêa IV; Bruna Marin Fronza IV; Fernanda Colla V
I Especialista em Endodontia Unicsul - SP, aluno PPG Odonto (nível de mestrado) da Universidade de Passo Fundo, Passo Fundo - RS, Brasil
II Especialista em prótese dentária - USP, mestre em Laser em Odontologia (Lelo)-USP. Mestre e Doutor em Materiais Dentários, Unicamp. Professor Titular das disciplinas de Dentística e Materiais Dentários - Foupf. Professor do Programa de Mestrado - Foupf, Passo Fundo - RS, Brasil
III Especialista em CTBMF, Santa Casa, Porto Alegre. Mestra em Ciências Médicas - Ufrgs. Cirurgiã bucomaxilofacial, Hospital São Vicente de Paulo de Passo Fundo
IV Acadêmicas da Faculdade de Odontologia, Universidade de Passo Fundo, Passo Fundo - RS, Brasil
V Acadêmica da Faculdade de Medicina Veterinária, Universidade de Passo Fundo, Passo Fundo - RS, Brasil. Bolsista Pibic CNPq
RESUMO
Objetivo: avaliar, in vitro, a efetividade antimicrobiana da clorexidina (CHX) 2% gel e do hipoclorito de sódio (NaOCl) a 2,5%, associado ao preparo mecânico do canal radicular em canais infectados com Enterococcus faecalis. Métodos: quarenta e cinco pré-molares com um único canal foram inoculados com E. faecalis por 14 dias. As raízes foram divididas em três grupos (n = 15): GP - grupo de controle positivo, sem tratamento, e G1 e G2, preparados mediante técnica híbrida (manual + Pro- Taper) e irrigados com CHX 2% e NaOCl 2,5%, respectivamente. Cinco pré-molares não receberam o inóculo, sendo o grupo de controle negativo (GN). Testes microbiológicos (contagem de UFC) foram realizados para avaliação dos tratamentos propostos. As médias dos grupos foram comparadas por Anova, complementada pelo teste de Tukey a 5% de significância. Resultados: não houve diferença estatística entre o hipoclorito de sódio 2,5% e a clorexidina gel 2% (p > 0,05), que reduziram significativamente o E. faecalis em 99,57% e 99,30%, respectivamente, em relação ao grupo de controle positivo. Conclusão: as substâncias testadas, CHX 2% gel e NaOCl 2,5%, são substâncias químicas auxiliares do preparo químico-mecânico do canal que promoveram uma redução significativa do E. faecalis.
Palavras-chave: Clorexidina. Enterococcus faecalis. Hipoclorito de sódio. Irrigantes do canal radicular.
ABSTRACT
Objective: to evaluate, in vitro, the antimicrobial effectiveness of 2% chlorhexidine (CHX) gel and 2.5% sodium hypochlorite (NaOCl), associated to mechanical preparation of root canals on roots infected by Enterococcus faecalis. Methods: forty five inferior single-rooted premolars were inoculated with E. faecalis during 14 days. The roots were separated in three groups (n = 15): PG – positive control group, without treatment; G1 and G2, prepared by hybrid technique (manual + ProTaper) and irrigated with 2% CHX and 2.5% NaOcl, respectively. Five premolars were not inoculated, once they make the negative control group (NG). Microbiological tests (CFU counting) were used to evalua te the treatments. Means were compared by Anova and complemented by Tukey test at 5% significance Results: there was no statistical difference among 2.5% sodium hypochlorite and 2% (p > 0,05) chlorhexidine gel, which significantly reduced E. Faecalis in 99.57% and 99.30%, respectively, compared to the positive control group. Conclusions: the substances tested, 2% CHX gel and 2.5% NaOCl are auxiliary chemical substances of the chemo-mechanical preparation that promote a significant reduction of E. faecalis.
Keywords: Chlorhexidine. Enterococcus faecalis. Root canal irrigants. Sodium hypochlorite.
Introdução
A presença de micro-organismos pós-necrose pulpar é fundamental para o estabelecimento da periodontite apical. Em dentes com necrose pulpar, os micro-organismos são inicialmente restritos ao sistema de canais radiculares. No entanto, os túbulos dentinários1-2 e ramificações do canal são importantes áreas de propagação, contribuindo para a criação de um grande número de formas microbianas. A desinfecção endodôntica é realizada com preparo químico-mecânico (PQM), uma associação de modelagem e desinfecção do conduto radicular com auxílio de substâncias químicas. Mesmo com as atuais técnicas de instrumentação e os diferentes tipos de soluções irrigantes auxiliares, como hipoclorito de sódio e clorexidina, existe dificuldade quanto à sua penetração e ação nos sistemas de canais radiculares, devido às diferentes formas e à resistência dos patógenos presentes4. O Enterococcus faecalis é uma bactéria gram-positiva anaeróbia facultativa que possui a capacidade de proliferar na presença ou ausência de oxigênio. Essa resistência reside, principalmente, na capacidade de crescimento como um biofilme nas paredes do canal radicular5 e na facilidade em penetrar no interior dos túbulos dentinários6. O E. faecalis está associado ao insucesso na terapia endodôntica, podendo permanecer viável nos canais de raízes obturadas até 12 meses após o tratamento, e é capaz de penetrar nos túbulos dentinários até 100 μm a partir da luz do canal7, tornando fonte residual, e mantendo infecções persistentes8-9.
As qualidades desejáveis de um irrigante incluem a capacidade de dissolver tecido pulpar e restos de tecidos orgânicos, bem como de remover a camada de esfregaço (smear layer), além de baixa toxicidade, proporcionando um efeito bactericida e bacteriostático. O hipoclorito de sódio (NaOCl) é o irrigante mais frequentemente utilizado no tratamento endodôntico. Tem atividade solvente para os tecidos necróticos e vitalizados, é antibacteriano, mas também revela um efeito citotóxico, pois, quando injetado para os tecidos periapicais, tem ainda potencial corrosivo e pode causar reações alérgicas8, mau cheiro e gosto desagradável9. A clorexidina (CHX) é um potente agente antimicrobiano com substantividade, tendo eficácia sobre as bactérias gram-negativas e gram-positivas, bem como as leveduras. Contudo, micobactérias, esporos e a maioria dos vírus são resistentes a essa substância10. O hipoclorito de sódio e a clorexidina não possuem ação sobre os componentes inorgânicos da camada de esfregaço (smear layer). Irrigação com soluções, tais como ácido etilenodiaminotetracético (EDTA), têm sido recomendadas como adjuvantes no tratamento do canal radicular, tendo em vista a sua capacidade de remover a camada de matéria inorgânica11.
Diante do exposto, o objetivo do presente estudo foi avaliar, in vitro, a efetividade antimicrobiana da CHX 2% gel e do NaOCl 2,5%, associado ao preparo mecânico do canal radicular, em canais infectados com E. faecalis, testando a hipótese de que ambas substâncias reduzirão as contagens bacterianas.
Materiais e método
O projeto foi aprovado pelo Comitê de Ética em Pesquisa da Universidade de Passo Fundo pelo parecer nº 229/2011.
Cinquenta raízes de pré-molares inferiores unirradiculares, fornecidas pelo Banco de Dentes da Faculdade de Odontologia (FO) da Universidade de Passo Fundo, foram radiografadas, com o objetivo de verificar a presença de canal único, cortadas abaixo da junção amelocementária, no sentido perpendicular ao longo do eixo da raiz, com disco diamantado, padronizando um comprimento de 13 mm e, depois, limpas e esvaziadas com o auxílio de lima tipo KF # 15 (Dentsply-Maillefer, Ballaigues, Switzerland) e hipoclorito de sódio a 2,5% para remoção dos restos pulpares. Após, as amostras foram alargadas até a lima tipo KF # 30 (Dentsply-Maillefer), com desgaste cervical com broca de Gates Glidden nº 3 (Dentsply-Maillefer, Ballaigues, Switzerland), para padronizar o diâmetro dos canais. As raízes foram impermeabilizadas externamente com cianoacrilato (Super Bonder®, Loctite Henkel, Itapevi, SP, Brasil) e secadas em temperatura ambiente por 24h. A seguir, foram montadas em tubos Eppendorf de 1,5 ml e envoltas em silicone pesado de condensação (Zetaplus, Zhermack, Rovigo, Itália) para lhes dar suporte. Na sequência, foram esterilizadas em autoclave a 134 oC por 15min (Cristófoli Ltda, Campo Mourão, Brasil) para receber o inóculo, tendo cinco delas sido escolhidas, aleatoriamente, para o controle negativo (GN), não recebendo o inóculo.
Preparo do inóculo
Para a contaminação das amostras, utilizou-se inóculo de uma cepa de E. faecalis (ATCC 29212) em um tubo de ensaio contendo 5 ml de caldo Tryptic Soy Broth (TSB - Merck®, Rio de Janeiro, RJ, Brasil) e incubada por 24h a 37 oC. Após o período de incubação, ajustou-se o grau de turbidez do inóculo, de acordo com a escala 1,0 de Mac Farland, que corresponde a 3,0 x 108 células, referente a uma densidade ótica de 0,25 a 550 nm12.
Contaminação dos canais radiculares
Com o auxílio de seringas descartáveis estéreis (Med-Inject®,São Sojé, SC, Brasil) de 1 ml, aspirou-se uma alíquota de 0,5 ml do inóculo contido no tubo e, após, suspendeu-se o conteúdo da seringa no interior dos canais radiculares até o seu preenchimento completo. Diariamente, uma nova cultura com turbidez equivalente era injetada nos canais radiculares das amostras, durante 14 dias em temperatura de 37 oC.
Divisão dos grupos
As amostras foram divididas, aleatoriamente, em uma bancada de fluxo laminar horizontal em grupo de controle negativo – GN (n = 5); grupo de controle positivo – GP (n = 15); grupo que recebeu tratamento com hipoclorito de sódio a 2,5% (Natupharma, CRF 2288, Passo Fundo, RS, Brasil) – G1 (n = 15); grupo com tratamento com clorexidina gel 2% (Clean Form 2% gel, Fórmula & Ação, São Paulo, SP, Brasil) – G2 (n = 15).
Controle dos níveis de contaminação (grupos de controle)
Grupo de controle positivo (GP): após o período de incubação de 14 dias, pontas de papel absorvente estéril de tamanho # 35 (Tanari R, Manacapuru, AM, Brasil) foram inseridas nos canais durante 15s, retiradas e acondicionadas, individualmente, em tubos Eurotype, contendo 1 mL de solução fisiológica 0,9% (Baso, Caxias do Sul, RS, Brasil). Após, cada tubo foi sonicado durante 20s para a realização das diluições seriadas até 10-4 e semeadas na superfície da placa contendo Agar PCA (Plate Count Agar- AES®, Cranbury, EUA). As placas foram incubadas durante 48 horas, a 37 oC, para observar o crescimento no material coletado das amostras de cada grupo avaliado.
Grupo de controle negativo (GN): após 14 dias as amostras foram preenchidas com solução de Ringer esterilizada e, após, pontas de papel esterilizadas foram inseridas no comprimento de trabalho e deixadas por 15s para absorver o conteúdo do conduto radicular, retiradas e acondicionadas, individualmente, em tubos Eurotype, contendo 1 mL de solução fisiológica 0,9%. Cada tubo foi sonicado durante 20s, não realizando diluições 100. Semeadas em placas contendo Agar Plate Count Agar (PCA-AES®, Cranbury, EUA), as placas foram incubadas durante 48h, a 37 oC, para confirmar que não houve crescimento no material coletado das amostras.
Tratamentos
Utilizou-se um suporte de latão com um orifício na parte superior para fixar o tubo Eppendorf de 1,5 mL com a amostra a fim de realizar os tratamentos (Fig. 1).

No G1 (n = 15), foi realizada instrumentação híbrida com sistema rotatório Protaper (Dentsply-Maillefer, Ballaigues, Switzerland), com as limas SX, F2 e F3 e limas manuais tipo KF # 35 e # 40 (Dentsply-Maillefer, Ballaigues, Switzerland). Procedeu-se a irrigação de 4 mL de solução de NaOCl 2,5% em cada troca de instrumento, totalizando 20 mL de solução de NaOCl a 2,5% para cada amostra, por meio da técnica coroa-ápice. Seguiu-se irrigação com 5 mL de EDTA-T 17% (Fórmula & Ação, São Paulo, SP, Brasil), e irrigação final com 5 mL de soro fisiológico e secagem com pontas de papel absorvente esterilizadas (Tanari®).
No G2 (n = 15), procedeu-se à instrumentação híbrida da mesma forma que o grupo anterior, utilizando aproximadamente 1 mL de gel de clorexidina a 2% (Clean Form 2% gel, Fórmula & Ação, São Paulo, SP, Brasil) e irrigação com 5 mL de soro fisiológico (Baso, Caxias do Sul, RS, Brasil) a cada troca de instrumento, totalizando 5 mL de gel com o total de irrigação de 20 mL de soro fisiológico para amostra, durante o preparo. Seguiu-se com 5 mL de EDTA-T 17% (Fórmula & Ação), e irrigação final com 5 mL de soro fisiológico e secagem com pontas de papel absorvente esterilizadas (Tanari®, Manacapuru, AM, Brasil).
Análise microbiológica após os tratamentos
Após o tratamento, a solução de Ringer estéril foi colocada em todos os canais e pontas de papel estéreis foram inseridas no comprimento de trabalho e deixadas por 15s para absorver o conteúdo do conduto radicular. As pontas de papel foram, então, retiradas e acondicionadas em tubos Eurotype® contendo 1 mL de solução fisiológica 0,9% esterilizada, para serem sonificadas, durante 20s, e plaqueadas em duplicata. Posteriormente, as placas de Petry contendo Agar foram semeadas com 25 μL e incubadas durante 48h na temperatura de 37 °C, para realização de contagem direta de colônias13, tendo sido considerada incontável amostra com número superior a 300 UFC.
As médias foram comparadas utilizando Anova e teste de Tukey a 5% de significância.
Resultados
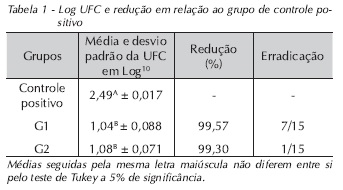
Os resultados mostraram que não houve diferença estatística significativa entre G1 e G2 (p > 0,05), havendo, porém, diferença estatística significativa desses grupos em relação ao grupo controle positivo (p > 0,05) (Tab. 1). O G1 teve redução microbiana, em relação ao grupo de controle positivo, de 99,57%, apresentando erradicação de sete amostras de um total de 15, tendo como tempo médio de preparo 7min e 30s para cada raiz; já o G2 teve redução microbiana de 99,30% em relação ao grupo de controle positivo e erradicação de apenas uma amostra de um total de 15 e tempo médio de preparo de 8min e 30s, para cada raiz. O grupo de controle negativo não apresentou crescimento bacteriano em nenhuma das cinco amostras.
Discussão
O E. faecalis é uma das espécies predominantes nos casos de lesões refratárias ao tratamento14-17. Por isso, grande parte da pesquisa endodôntica atual procura formas mais eficientes de combater esse micro-organismo. No presente estudo, optamos por realizar uma técnica híbrida, ou seja, associação de instrumentos manuais e rotatórios, com o objetivo de diminuir o tempo de preparo dos canais, bem como menor fadiga do operador18 e principalmente a tentativa de simular uma situação real da clínica endodôntica, ao qual nem sempre conseguimos o alargamento que desejamos. As raízes foram preparadas para receber o inóculo de E. faecalis até a lima KF # 30 na porção apical e Gates Glidden número 3, o que representa um desgaste de 0,30 mm na apical e 0,5 mm na cervical. Após as amostras serem contaminadas por 14 dias, utilizamos no terço cervical a lima SX (ProTaper), o que representa um desgaste final de 1,02 mm a 12 mm (comprimento de trabalho no estudo) e no terço apical (ápice) a lima KF # 40 (0,4 mm), podendo ser considerado um alargamento pequeno, tendo em vista que o micro- organismo utilizado na pesquisa pode penetrar até 1.000 μm (1 mm)19.
Nossos resultados apontam que, mesmo com o emprego de meios mecânicos (mediante emprego de instrumentos endodônticos), físicos (através de irrigação e aspiração) e químicos (capacidade antimicrobiana da solução irrigadora), não foi possível controlar de forma absoluta a infecção do sistema de canais radiculares, o que corrobora os achados de Siqueira et al.14 (2008), mas as populações bacterianas foram reduzidas para níveis abaixo da capacidade de detecção dos métodos de cultura dependente. O G1 teve redução microbiana, em relação ao grupo de controle positivo, de 99,57%, apresentando erradicação de sete amostras de um total de 15. O G2 teve redução microbiana de 99,30% em relação ao grupo de controle positivo e erradicação de apenas uma amostra de um total de 15. Mesmo não tendo diferença estatística entre o G1 e G2, o grupo em que utilizamos a CHX apresentou um menor número de redução de UFCs e erradicação. Talvez esse fato possa estar vinculado ao esquema de irrigação empregado, onde a CHX gel foi aplicada e, após a utilização do instrumento, o canal era irrigado com 5 mL de soro fisiológico, que provavelmente diluía o gel no interior do conduto, diminuindo o tempo de ação e o contato dessa substância com as paredes do canal radicular. Além disso, o estado de gel da substância pode ter prejudicado sua difusão no canal radicular. Gomes et al. (2009),15 relataram que uma formulação menos viscosa da CHX poderia facilitar a instrumentação e sua penetração, aumentando, assim, a remoção mecânica de contaminantes do canal radicular.
Os resultados indicaram que a clorexidina em gel 2% (G2) tem grande potencial para ser usada como substância química auxiliar no PQM, confirmando os achados de Gomes et al. (2001)20, que verificaram que solução de clorexidina gel 2% e Na- OCl 5,25% tinham desempenhos similares contra E. faecalis. Nessa mesma perspectiva, no presente estudo, o gel de clorexidina a 2% obteve resultados semelhantes ao NaOCl a 2,5% quanto à redução bacteriana em relação ao grupo de controle.
Siqueira et al. (2001)21 realizaram estudo clínico para comparar a eficácia do NaOCl 2,5% e gluconato de clorexidina a 0,12% como soluções irrigantes em canais infectados de dentes com periodontite apical. Concluíram os autores que não houve diferença significativa entre as duas soluções irrigantes, confirmando os resultados deste estudo em relação ao NaOCl e à clorexidina, que não conseguiram promover a esterilização dos condutos. É possível que o E. faecalis tenha sofrido mutações genéticas em razão das suas passagens por laboratórios e multiplicações, com alteração do seu genótipo e fenótipo, aumentando, assim, sua resistência22.
Há muitas razões para a persistência bacteriana nos canais após a instrumentação e irrigação com NaOCl ou clorexidina. Uma delas é que as bactérias persistentes podem ser intrinsecamente resistentes ao irrigante, ou persistir se estiverem presentes em áreas inacessíveis aos efeitos dos instrumentos e irrigantes. Outra razão está no curto tempo de contato da substância química auxiliar com o biofilme bacteriano e na possibilidade de as bactérias persistentes serem incorporadas em remanescentes de tecido ou organizadas em estruturas como o biofilme bacteriano, ficando protegidas contra os efeitos letais de irrigantes21.
Retamozo et al. (2010)16 afirmaram que a irrigação durante 40min com NaOCl a 2,5% é ineficaz na eliminação do E. faecalis. No presente estudo, o tempo médio do PQM do G1 foi de 7min e 30s, e apesar de ser pouco tempo de contato, obteve-se um resultado de erradicação (7 de 15 amostras) e de redução microbiana bastante positivo.
As descobertas atuais não mostram diferença significativa entre clorexidina e NaOCl no que diz respeito à atividade antimicrobiana15-17,20-25. A clorexidina tem demonstrado ser menos tóxica do que o NaOCl8,26, sendo importante ressaltar que, quanto maior a concentração do NaOCl, maior o seu poder bactericida, tornando-se mais tóxico aos tecidos periapicais16,27,28. Por outro lado, o hipoclorito de sódio possui baixa tensão superficial (ação umectante) e pH alcalino quando não exposto à luz e armazenado de forma correta29, e é solvente de matéria orgânica30. Além disso, uma desvantagem importante da clorexidina é a incapacidade de dissolução tecidual.
Conclusões
Pode-se concluir que ambas as soluções utilizadas neste estudo apresentaram redução microbiana significativa com mais de 99% em relação ao grupo de controle. Esses níveis de redução podem ser compatíveis com cicatrização dos tecidos perirradiculares, na maioria dos casos14. As duas substâncias propostas neste estudo não promoveram a erradicação do E. faecalis.
Referências
1. Safavi KE, Spangberg LS, Langeland K. Root canal dentinal tubule disinfection. J Endod 1990; 16(5):207-10. [ Links ]
2. Nair PN, Henry S, Cano V, Vera J. Microbial status of apical root canal system of human mandibular first molars with primary apical periodontitis after "one-visit" endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99:231-52.
3. Soares IJ, Goldemberg F. Endodontia: técnica e fundamentos. Porto Alegre: Artmed; 2001.
4. Ferraz CCR, Gomes BPFA, Zaia AA, Teixeira FB, Souza-Filho FJ. In vitro assessment of the antimicrobial action and the mechanical ability of chlorhexidine gel as an endodontic irrigant. J Endod 2001; 27:452-5.
5. Körstgens V, Flemming HC, Wingender J, Borchard W. Uniaxial compression measurement device for investigation of the mechanical stability of biofilms. J Microbiol Methods 2001; 46(1):9-17.
6. Nair PN. Light and electron microscopic studies of root canal flora and periapical lesions. J Endod 1987; 13:29-39.
7. Haapasalo M, Orstavik D. In vitro infection and desinfection of dentinal tubules. J Dent Res 1987; 66(8):1375-9.
8. Tirali RE, Turan Y, Akal N, Karahan ZC. In vitro antimicrobial activity of several concentrations of NaOCl and Octenisept in elimination of endodontic pathogens. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108(5):117-20.
9. Ariaz-Moliz MT, Ferrer-Luque CM, González-Rodríguez M. P, Valderrama MJ, Baca P. Eradication of Enterococcus faecalis Biofilms by Cetrimide and Chlorhexidine. J Endod 2010; 36(1):87-90.
10. Haapasalo M, Endal U, Zandi H, Coil J. Eradication of endodontic infection by instrumentation and irrigation solutions. Endod Top 2005; 10:71-102.
11. Ariaz-Moliz MT, Ferrer-Luque CM, Espigares-García M, Baca P. Enterococcus faecalis biofilms eradication by root canal irrigants. J Endod 2009; 35(5):711-4.
12. Souza EB, Cai S, Simionato MR, Lage-Marques JL. Highpower diode laser in the disinfection in depth of the root canal dentin. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 106(1):68-72.
13. Madigan MT, Madingo JM, Parker J. Microbiologia de Brock. 10. ed. São Paulo: Person Prentice-Hall; 2004.
14. Siqueira Jr. JF, Rôças JF. Clinical Implications and Microbiology of Bacterial Persistence after Treatment Procedures. J Endod 2008; 34(11):1291-301.
15. Gomes BP, Martinho FC, Vianna ME. Comparison of 2.5% sodium hypochlorite and 2% chlorhexidine gel on oral bacterial lipopolysaccharide reduction from primarily infected root canals. J Endod 2009; 35(10):1350-3.
16. Retamozo B, Shabahang S, Johnson N, Aprecio RM, Torabinejad M. Minimum Contact Time and Concentration of SodiumHypochlorite Required to Eliminate Enterococcus faecalis Bonnie. J Endod 2010; 36(3):520-3.
17. Jeansonne, M. J.; White, R. R. A comparison of 2.0% chlorhexidine gluconate and 5,25% sodium hypochlorite as antimicrobial endodontic irrigants. J Endod 1994; 2(6):276- 81.
18. Estrela C, Figueiredo JAP. Hibrid technique for curve root canal preparation. ROBRAC 2001; 10(30):14-21.
19. Sundqvist G, Figdor D, Persson S, Sjögren U. Microbiologic analysis of teeth with failed endodontic treatment and the outcome of conservative re-treatment. OralSurg Oral Med Oral Pathol Oral Radiol Endod,1998; 85(1):86-93.
20. Gomes BP, Ferraz CC, Vianna ME, Berber VB, Teixeira FB, Souza-Filho FJ. In vitro antimicrobial activity of several concentrations of sodium hypochlorite and chlorhexidine gluconate in the elimination of Enterococcus faecalis. Int Endod J 2001; 34(6):424-8.
21. Siqueira Jr. JF, Rôças JF, Paiva SS, Guimarães-Pinto T, Magalhães KM, Lima KC. Bacteriologic investigation of the effects of sodium hypochlorite and chlorhexidine during the endodontic treatment of teeth with apical periodontitis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 104(1):104-22.
22. Haapasalo M, Wei Q, Portenier I, Waltimo T. Effects of dentin on the antimicrobial properties of endodontic medicaments. J Endod 2007; 33:917-25.
23. Heling I, Chandler NP. Antimicrobial effect of irrigant combinations within dentinal tubules. Int Endod J 1998; 31(1):8-14.
24. Sen, B. H.; Safavi, K. E.; Spangberg, L. S. Antifungal effects of sodium hypochlorite and chlorhexidine in root canals. J Endod 1999; 25(4):235-8.
25. Ercan, E.; Ozekinci, T.; Atakul, F.; Gül, K. Antibacterial activity of 2% chlorhexidine gluconate and 5,25% sodium hypochlorite in infected root canal: in vivo study. J Endod 2004; 30(2):84-7.
26. Tanomaru Filho, J. M.; Leonardo, M. R.; Silva, L. A.; Aníbal, F. F.; Faccioli, L. H.Inflammatory response to different endodontic irrigating solutions. Int Endod J 2002; 35(9):735-39.
27. Chang YC, Huang FM, Tai KW, Chou MY. The effect of sodium hypochlorite and chlorhexidine on cultured human periodontal ligament cells. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001; 92(4):446-50.
28. Pelka M, Petschelt A. Permanent mimic musculature and nerve damage caused by sodium hypochlorite: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 106(3):80-3.
29. Camps J, Pommel L, Aubut V, Verhille B, Satoshi F, Lascola B, About I. Shelf life, dissolving action, and antibacterial activity of a neutralized 2,5% sodium hypochlorite solution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108(2):66-73.
30. Sena NT, Gomes BP, Vianna ME, Berber VB, Zaia AA, Ferraz CC et al. In vitro antimicrobial activity of sodium hypochlorite and chlorhexidine against selected singlespecies biofilms. Int Endod J 2006; 39(11):878-85.
 Endereço para correspondência:
Endereço para correspondência:
Eduardo Dall' Magro
Rua Paissandú, 641/803
99010-100 Passo Fundo - RS
e-mail: dallmagro@upf.br
Recebido: 18/01/2012
Aceito: 10/08/2012