Services on Demand
Article
Related links
Share
RGO.Revista Gaúcha de Odontologia (Online)
On-line version ISSN 1981-8637
RGO, Rev. gaúch. odontol. (Online) vol.58 n.1 Porto Alegre Jan./Mar. 2010
ORIGINAL ORIGINAL
Associação entre periodontite e doença pulmonar
Association between periodontitis and lung disease
Fabiano Rito MacedoI,1; Eduardo Saba-ChujfiII; Sílvio Antonio Santos PereiraII; Elton Luiz da CostaIII; José Pereira de Melo NetoII
IUniversidade Paulista, Faculdade de Odontologia. Av. Mário Ypiranga, 4390, 69050-030, Parque 10 de Novembro, Manaus, AM, Brasil
IIFaculdade São Lepoldo Mandic, Faculdade de Odontologia. Campinas, SP, Brasil
IIIAssociação Brasileira de Odontologia. Governador Valadares, MG, Brasil
RESUMO
OBJETIVO: Verificar a associação entre a doença periodontal e a doença pulmonar, a partir de um levantamento epidemiológico, caso e controle, em pacientes que frequentaram o pronto atendimento da Fundação Hospital Adriano Jorge, no período de junho de 2006 a fevereiro de 2007, na cidade de Manaus, Amazonas, Brasil.
MÉTODOS: A amostra foi composta por 140 pacientes, sendo que pacientes com pneumonia adquirida na comunidade esteve presente em 60% (n = 70) e a doença pulmonar obstrutiva crônica em 40% (grupo-caso) e 70 pacientes sem doença respiratória (grupo-controle), com a idade variando entre 19 e 69 anos, apresentando média de 41,3, desvio-padrão 13,6 anos. Os parâmetros clínicos para avaliar as alterações periodontais foram obtidos por meio da profundidade de bolsa, do sangramento a sondagem, do índice de placa e da perda de inserção clínica.
RESULTADOS: Ambos os grupos não apresentaram diferença significativa em nenhuma das variáveis de controle (p>0,05). Os grupos apresentaram diferença significativa apenas no índice de placa (p<0,05) sendo média de 0,36, desvio-padrão de 0,30 nos controles e nos casos média de 0,51, desvio-padrão 0,35.
CONCLUSÃO: A doença periodontal não apresentou associação significativa com a doença pulmonar, tanto em gravidade quanto na extensão (p>0,05). Devido ao aumento do índice de placa bacteriana na cavidade bucal de pacientes com doenças respiratórias, novos estudos devem ser realizados para verificar qual a relação entre as duas doenças.
Termos de indexação: periodontia; periodontite; pneumopatias.
ABSTRACT
OBJECTIVE: To verify the association between periodontal disease and lung disease from an epidemiological, case and control survey, in patients who attended the first aid service of the Adriano Jorge Foundation Hospital, Manaus, Amazonas, Brazil, from June 2006 to February 2007.
METHODS: The sample consisted of 140 patients, among whom community-acquired pneumonia was present in 60% (n = 70), and chronic obstructive pulmonary disease in 40% (case-group); and 70 patients without respiratory disease (control group), ranging between 19 and 69 years of ages, with a mean age of 41.3, and standard deviation of 13.6 years. The clinical parameters for evaluating periodontal changes were obtained by means of pocket depth, bleeding on probing, plaque index and clinical attachment loss.
RESULTS: Both groups showed no significant difference in any of the control variables (p>0.05). The groups showed significant difference only in the plaque index (p <0.05) and the mean was 0.36, standard deviation 0.30 in control group, and in the cases a mean of 0.51, standard deviation 0.35.
CONCLUSION: Periodontal disease showed no significant association with lung disease, both in severity and extension (p> 0.05). Due to the increase in the bacterial plaque index in the oral cavity of patients with respiratory diseases, further studies should be conducted to verify what the relationship between the two diseases is.
Indexing terms: periodontics; periodontitis; lung diseases.
INTRODUÇÃO
A doença periodontal ocorre, em grande parte, nos indivíduos devido à falta de um programa de saúde bucal preventiva, para controlar a microbiota bucal patogênica responsável pelo seu início e evolução. A periodontite crônica foi definida como uma doença multifatorial, causada principalmente por microorganismos Gram-negativos, que estimulam a produção de citocinas pró-inflamatórias, secretadas pelas células do sistema imunológico1.
Flemming2 relacionou os sinais clínicos da periodontite como sendo: perda de inserção clínica, perda óssea alveolar, profundidade de bolsa e sangramento a sondagem, aumento da mobilidade dental e com características histopatológicas (formação de bolsa periodontal, migração do epitélio juncional para apical, perda de fibras colágenas, infiltrados de células inflamatórias no epitélio juncional e na bolsa periodontal).
Doença periodontal1-2 e doenças pulmonares crônicas3-5 possuem os microorganismos anaeróbios Gram-negativo como fator etiológico principal, levando a uma resposta imunológica e inflamatória com liberação de substancias biológicas ativas.
A cavidade oral foi considerada por muito tempo um potencial reservatório de patógenos respiratórios. Os mecanismos de infecção que podem ser citados são: a) a aspiração pelo pulmão de patógenos orais capazes de causar pneumonia; b) a colonização da placa dentária por patógenos respiratórios seguida da aspiração; c) a facilidade da colonização dos patógenos periodontais na via aérea superior6.
Os idosos que vivem em enfermarias e casas de repouso são mais suscetíveis a se tornarem doentes ou a morrerem por infecções do trato respiratório baixo ou por outras infecções, que pode estar atribuído a uma mudança nos mecanismos de defesa do hospedeiro e a uma exposição a microorganismos patogênicos. A composição bacteriana tende a modificar frente a falta de higiene oral e a infecções bucais, como gengivite e periodontite. Assim, a elevada incidência e a maior gravidade das infecções orais em idosos, residentes em casas de enfermagem, resultam do elevadíssimo nível de microorganismos patogênicos na cavidade oral e nos fluidos da orofaringe5-6.
A doença pulmonar obstrutiva crônica é caracterizada pela obstrução das vias aéreas devido à bronquite crônica e/ou enfisema7. A bronquite crônica é uma condição inflamatória associada com a produção de muco suficiente para causar tosse com expectoração por no mínimo três meses ao ano, por dois ou três anos7. O enfisema pulmonar como sendo uma doença que destrói as paredes alveolares pulmonares, com ampliações anormais dos espaços aéreos para o bronquíolo terminal, possui características de uma doença inflamatória com participação ativa de macrófagos, neutrófilos e linfócitos em sua patogênese. Associada aos estímulos oxidantes diretos das estruturas pulmonares, que desencadeiam reações bioquímicas, levam a progressiva desorganização das pequenas vias aéreas e ao remodelamento estrutural não reversível8. A liberação de substâncias provenientes das células recrutadas e do estresse oxidativo pode levar, também, ao desequilíbrio inicialmente temporário dos mecanismos de defesa pulmonar. A permanência desse desequilíbrio é uma das chaves da fisiopatogenia atual9.
A pneumonia foi definida como uma infecção do parênquima pulmonar, causada por fungos, vírus, infecção parasitária ou bacteriana e que se inicia através de colonização da cavidade oral e da mucosa da faringe por patógenos respiratórios potenciais, da aspiração dos patógenos pelo trato aéreo inferior e pelo fracasso dos mecanismos de defesa do hospedeiro. A pneumonia bacteriana pode ser classificada como pneumonia adquirida na comunidade ou hospitalar (nosocomial). Mais de 5,6 milhões de casos de pneumonia adquirida na comunidade acontecem anualmente nos Estados Unidos da América (USA) e a taxa geral de mortalidade é de 5% dos casos. Porém, 1,1 milhão de casos de pneumonia adquirida na comunidade requer hospitalização e a taxa de mortalidade varia de 12% na população geral para 40% nos casos admitidos em unidades de cuidados intensivos.
A pneumonia adquirida na comunidade é causada tipicamente pela aspiração de bactérias que normalmente residem na orofaringe, como Streptococcus pneumoniae, Haemophilus influenzae e Mycoplasma pneumoniae. A pneumonia nosocomial acomete principalmente indivíduos institucionalizados, como pacientes em terapia intensiva e que estão em casas de repouso e responde por 10% a 15% de todas as infecções hospitalares, com uma taxa de mortalidade de 25%, sendo causadas por Pseudomonas aeruginosa, Staphylococcus aureus e bactérias entéricas Gram-negativas como Klebsiella pneumoniae, Escherichia coli e espécies de Enterobacter5, que normalmente não colonizam a orofaringe.
Os pacientes em unidade de cuidado intensivo possuem higiene bucal deficientes levando a um aumento do índice da placa bacteriana na cavidade bucal, e da orofaríngea10. A colonização da orofaringe por bactérias Gram-negativas entéricas pode estar associada a infecções como pneumonia adquirida na comunidade11. A frequência da periodontite grave generalizada apresenta certa afinidade com estas doenças pulmonares12, quando avaliada nos parâmetros de extensão e gravidade13.
Apesar dos resultados dos estudos longitudinais apontarem uma associação entre doença periodontal e doença pulmonar, não há evidências de que esta relação é causal. O estado periodontal pode ser um indicador de risco e as duas doenças podem compartilhar um fato de susceptibilidade do hospedeiro comum relacionado à resposta subjacente. A natureza desta associação deve ser pesquisada e analisada em estudos futuros para poder ser confirmada como um fator de risco14.
Devido à revisão da literatura, este presente estudo do tipo caso-controle propôs verificar a associação entre a periodontite crônica e doenças respiratórias, em indivíduos com diagnóstico de pneumonia adquirida na comunidade e doença pulmonar obstrutiva crônica.
MÉTODOS
Seleção da amostra
Amostra contou com 140 pacientes de ambos os sexos, com idade variando entre 19 e 69 anos, divididos em 70 pacientes com diagnóstico médico de pneumonia adquirida na comunidade e doença pulmonar obstrutiva crônica (grupo-caso) e 70 pacientes que frequentaram a emergência por outros motivos sem nenhum problema respiratórios (grupo-controle). Os casos e os controles foram selecionados de forma sistemática, após a avaliação médica definitiva no decorrer do atendimento no Setor de Emergência da Fundação Hospital Adriano Jorge, no período de junho de 2006 a fevereiro de 2007. Foram excluídos da amostra, pacientes com menos de 18 anos de idade, com menos de 5 dentes, pacientes imunocomprometidos, com doenças auto-imunes, portadores de câncer, portadores de tuberculose e gestantes. Os terceiros molares não eram examinados.
Esta pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Fundação Hospital Adriano Jorge, na cidade de Manaus (AM), processo n° 014/2006.
Exame clínico
Os pacientes responderam um prontuário odontológico para a análise das suas alterações sistêmicas e locais. Este prontuário foi composto de um questionário que permitia a identificação do paciente (nome, idade, sexo, etnia, profissão, estado civil e endereço completo), além de informações sobre a saúde geral e a saúde bucal.
Após a avaliação médica definitiva, os pacientes foram submetidos à pesquisa proposta na Fundação de Hospital Adriano Jorge. Primeiramente, os pacientes foram orientados sobre a proposição e os objetivos da participação no estudo e posteriormente assinaram o Termo de Consentimento Livre e Esclarecido, de acordo com o modelo fornecido pelo Comitê de Ética em Pesquisa da Fundação Hospital Adriano Jorge.
Após todos os exames clínicos, os pacientes foram encaminhados para o tratamento odontológico gratuito nas clínicas da Universidade Estadual do Amazonas.
Para o exame periodontal, o examinador (especialista em periodontia) utilizou máscara, gorro e avental descartáveis, óculos de proteção, luvas estéreis, cabo e espelho clínico estéril, pinça para algodão estéril, sonda milimetrada manual estéril (PCP 15, Hu-Friedy, Rio de Janeiro, Brasil), rolo de algodão e gases estéreis, ficha periodontal e lanterna frontal Coghlan's® (Winnipeg, MB, Canadá).
O exame periodontal foi realizado por um único examinador, sendo todos os dentes examinados para verificar a profundidade de bolsa, perda de inserção clínica, sangramento a sondagem, índice de placa, obedecendo aos seguintes critérios de avaliação: a) presença ou não de placa bacteriana visível (padrão binominal) nas faces vestibulares proximais e palatinas (linguais), detectada pela passagem da sonda periodontal próxima à margem gengival; b) presença ou não de sangramento gengival a sondagem (padrão binominal) nas faces vestibulares, proximais e palatinas (linguais) após sondagem até a base do sulco ou da provável bolsa periodontal; c) perda de inserção clínica periodontal detectada em milímetros pela mensuração da sonda periodontal milimetrada manual (PCP 15, Hu-Friedy, Rio de Janeiro, Brasil), introduzida ao longo do eixo do dente em três pontos distintos das faces vestibulares e palatinas (linguais), correspondendo ao centro da face, ângulo mesio e distovestibular, mesio e distopalatina (lingual), utilizando a junção cemento-esmalte como ponto de referência; d) a profundidade de bolsa periodontal seguiu os mesmos critérios de pontos de sondagem da perda de inserção clínica periodon-tal, exceto as margens gengivais, que foi o ponto de referência para as mensurações. Todos os dados foram registrados em uma ficha periodontal.
A avaliação da inflamação gengival foi considerada quando ocorreu apenas sangramento gengival a sondagem, sem presença de bolsa periodontal, seguindo os seguintes critérios: a) pontos avaliados com profundidade de sondagem até 3mm com sangramento gengival; foram considerados apenas gengivite, classificada quanto à sua extensão em: gengivite localizada, quando a sua extensão em números de sítios envolvidos foi <30%; gengivite generalizada, quando o número de sítios envolvidos foi >30% e transferido para uma planilha; b) a presença de sangramento foi registrada com o número inteiro "1" e a ausência, com o número "0". Os resultados obtidos foram registrados na ficha periodontal15.
A quantidade de placa bacteriana foi realizada com auxílio de uma sonda periodontal, observando a presença ou ausência de depósito de placa em volta de todos os dentes avaliados. A presença de depósitos foi registrada com um número inteiro "1" e na ausência, o numero "0". Os resultados obtidos foram registrados numa ficha periodontal16.
A classificação quanto à extensão e gravidade da periodontia seguiu os critérios da Academia Americana de Periodontologia de 1999: a) quanto à extensão da doença periodontal: periodontite localizada, quando os números de sítios avaliados eram <30% e periodontite generalizada, quando os números de sítios avaliados eram >30%; b) quanto à gravidade da doença periodontal foi determinada pela perda de inserção clínica, de acordo com: periodontite leve; perda de inserção clínica entre 1 a 2mm; periodontite moderada; perda de inserção clínica entre 3 a 4mm e periodontite grave; perda de inserção igual ou superior a 5mm.
Os resultados obtidos foram transferidos para planilha que calculou o percentual da extensão e gravidade da doença periodontal.
Todos os dados obtidos a partir dos prontuários odontológicos foram transferidos para uma planilha que calculou o percentual da saúde sistêmica e saúde bucal dos pacientes.
Inicialmente, todas as variáveis foram estudadas de maneira descritiva, por meio do cálculo de frequências absolutas (n) e relativas (%), e no caso das variáveis contínuas, por meio do cálculo de Média (M), Desvio-Padrão (DP), mediana, valores de mínimo e de máximo.
Para avaliar a associação das variáveis categóricas com a variável resposta, estudou-se cada uma delas bivariadamente por meio do cálculo do Odds Ratio (OR) e seu respectivo intervalo de confiança, além do teste de qui-quadrado (ou exato de Fisher quando uma das escalas apresentou valor inferior a 5).
As diferenças de médias das variáveis contínuas entre os grupos-caso e controle foram avaliadas pelo teste de Mann-Whitney, pois a distribuição dos dados não passou pelo teste de aproximação à curva normal. Foi realizada a Regressão Logística Múltipla para cálculo do Odds Ratio ajustado. O nível de significância foi assumido em 5% e o software utilizado para análise foi o SAS® versão 8.2.
RESULTADOS
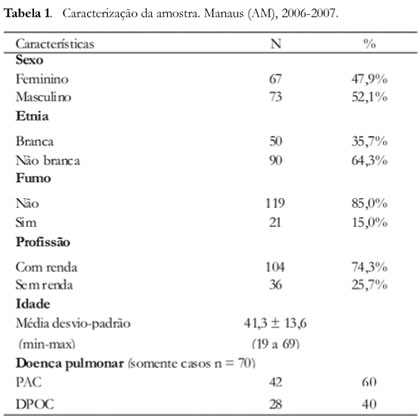
O percentual dos dados obtidos dos pacientes do grupos-caso e controle em relação as suas características quanto ao sexo, etnia, tabagismo, profissão, idade e doença pulmonar estão relacionadas na Tabela 1. A amostra foi composta por 140 pacientes, sendo 52,1% do sexo masculino e 47,9 do sexo feminino, 15,0% eram fumantes e a maioria das pessoas possuía renda (74,3%). A doença pulmonar pneumonia adquirida na comunidade esteve presente em 60,0% dos casos (n = 70) e a doença pulmonar obstrutiva crônica em 40,0%. A idade variou entre 19 a 69 anos apresentando M= 41,3, DP=13,6 anos.
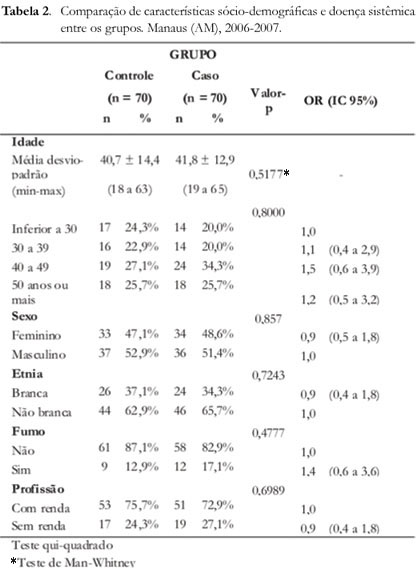
Os grupos não apresentaram diferença significante em nenhuma das variáveis de controle (p>0,05). A média de idade no grupo-controle foi de 40,7, DP=14,4 e nos grupo-caso foi M=41,8, DP=12,9. Ao avaliar-se a idade nas faixas etárias, observou-se que o Odds Ratio possui intervalos que passam pelo 1, portanto também um valor p não significativo (Tabela 2).
Os grupos apresentaram diferença significativa apenas no índice de placa (p<0,05) sendo M=0,36, DP=0,30 no grupo-controle e no grupo-caso (M=0,51, DP=0,35)(Tabela 3).
A doença periodontal não apresentou associação significativa com a doença pulmonar, tanto na gravidade quanto na extensão (p>0,05). A estimativa dos riscos não mostrou nenhum intervalo que estivesse totalmente como risco ou proteção (Tabela 4).
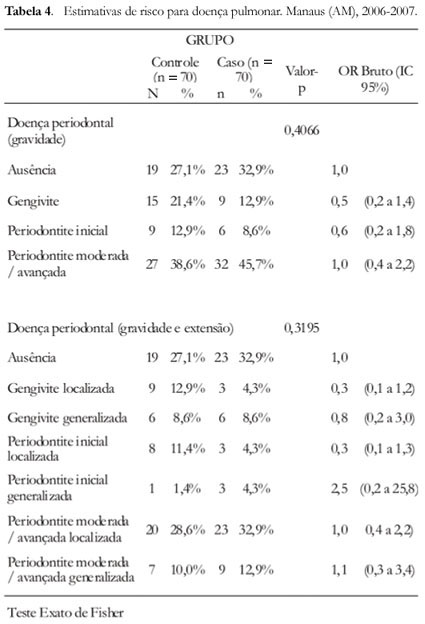
Em relação à distribuição da doença periodontal em relação ao grupo-caso e grupo-controle, o grupo-controle obteve um percentual de 21,4% para gengivite, 12,9% para periodontite inicial, 38,6% em periodontite moderada/avançada, enquanto que o grupo-caso obteve o percentual de 12,9% para gengivite, 8,6% para periodontite leve, 45,7% com periodontite moderada/avançada (Figura 1).
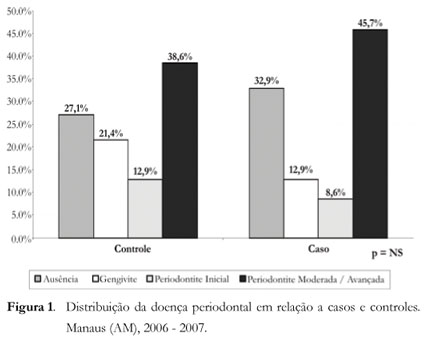
A Tabela 5 apresenta as estimativas ajustadas do risco. O ajuste elimina o efeito das variáveis pelo qual se faz o ajuste. Eliminou-se também o efeito das variáveis de controle.
Quando se eliminou o efeito das variáveis de controle, pôde-se observar que ainda assim não houve classes da doença periodontal que apresentassem riscos. Também foi estudada apenas a presença ou ausência da doença, não se detectando diferença significante.
DISCUSSÃO
Com o avanço dos estudos em relação à medicina periodontal, foi verificado que diversas doenças sistêmicas interferem no curso da evolução da patogênese da doença periodontal. A hipótese de que as condições orais, como infecções periodontais, podem ser fatores de risco ou indicativos de importantes consequências médicas, como a diabetes melitus17, artrite reumatóide18, parto pré-maturo19 e doenças cardiovasculares20.
O processo inflamatório é a resposta protetora do corpo às lesões ou infecções, sendo que os sinais clínicos clássicos que caracterizam a inflamação são: calor, rubor, tumor, dor e perda de função21, e esta resposta do hospedeiro podem liberar produtos biologicamente ativos1, tanto na doença periodontal14 como nas doenças pulmonares4,8-9.
Neste estudo, a comparação de características sócio-demográficas, doença sistêmica entre os grupos e os dados obtidos em relação à idade, etnia, sexo, profissão, observou-se que o Odds Ratio possui intervalos que passam pelo 1, portanto um valor p não significativo. As mesmas conclusões foram relatadas em outros trabalhos14,22.
A doença periodontal ocorre com maior frequência em pacientes adultos5,23-24, e, da mesma forma, a doença pulmonar atinge em maior porcentagem pacientes com idades mais avançadas5,11,13-14. O resultado obtido no presente estudo, à porcentagem de doenças pulmonares foi de 34,3% em pacientes com idade variando entre 40 a 49 anos e 25,7% em pacientes com idade igual ou maior que 50 anos, estando relacionado com as pesquisas citadas no parágrafo anterior. O hábito de fumar também é considerado um fator de risco para o agravamento da doença periodontal25. Neste estudo, os pacientes com pneumonia adquirida na comunidade e doença pulmonar obstrutiva crônica tiveram uma porcentagem de 17,1%, de acordo com outros estudos8,14,22,26 e o tabagismo é considerado um fator de risco preponderante para o aparecimento e/ou agravamento de doenças pulmonares.
De acordo com o estudo realizado, os resultados obtidos para sangramento a sondagem e a placa bacteriana não estiveram associados ao grupo de estudo, sendo associado à doença pulmonar no grupo-caso (p>0,05 e Odds Ratio com intervalo não significativo) e em ambos os grupos a maioria das pessoas possuíam sangramento e placa. Os grupos apresentaram diferença significativa apenas no índice de placa (p<0,05) sendo a média de 0,36, DP=0,30 nos controles e nos casos de M=0,51, DP=0,35, confirmando os trabalhos citados em relação ao aumento dos patógenos na cavidade oral em pacientes com doenças pulmonares3,5, e da orofaríngea10,13.
Em relação aos parâmetros clínicos para doença periodontal realizados nos pacientes examinados no presente trabalho, a perda de inserção clínica, profundidade de bolsa e sangramento a sondagem não alcançaram índices significantes entre o grupo-caso e o grupo-controle, sendo que p=0,40, p=0,80 e p=0,50, respectivamente. O aumento da profundidade de bolsa também não foi observado em outras pesquisas27-29. O sangramento a sondagem não obteve significância corroborando com achados de outros estudos29, mas a perda de inserção clínica foi superior em pacientes com doença periodontal associado às doenças pulmonares13 e a perda superior a 3mm estavam em risco mais alto para os pacientes com doença pulmonar obstrutiva crônica (OR= ,45: 95% CL= 1,02 a 2,05), além da função pulmonar parecer diminuir com o aumento da perda de inserção periodontal28.
Nesta pesquisa, a doença periodontal não apresentou associação significativa com a doença pulmonar, tanto na gravidade quanto na extensão (p>0,05). As mesmas conclusões foram relatadas em outros trabalhos14,29-30. Entretanto, em outros estudos, as associações entre as duas doenças podem ser considerados indicadores de risco13,28.
Os resultados obtidos no presente estudo não obtiveram significância entre as duas doenças, devido ao percentual de pacientes com doença periodontal do grupo-controle (72,9%) serem semelhantes ao percentual de pacientes do grupo-caso (67,1%), conforme detalhado na Figura 1.
CONCLUSÃO
Baseado nos resultados obtidos no presente estudo, pôde-se concluir que a doença periodontal não apresentou associação significativa com a doença pulmonar, tanto na gravidade quanto na extensão (p>0,05), em uma amostra de 140 pacientes (70 casos e 70 controles).
Colaboradores
FR MACEDO, E SABA-CHUJFI, SAS PEREIRA, EL COSTA e JP MELO NETO foram responsáveis por todas as etapas da elaboração do artigo.
REFERÊNCIAS
1. Saba-Chujfi E, Santos Pereira SA, Saba MEC, Saba AK. Medicina periodontal: uma visão integrada. In: Ottoni J. Cirurgias plásticas periodontais e periimplantares. São Paulo: Santos; 2007. p.241- 83. [ Links ]
2. Flemming TF. Periodontitis. Ann Periodontol. 1999;4(1):32-7. [ Links ]
3. Mojon P. Oral health and respiratory infection. J Can Dent Assoc. 2002;68(6):340-5. [ Links ]
4. Okuda K, Kimizuka R, Abe S, Kato T, Ishihara K. Involvement of periodontopathic anaerobes in aspiration pneumonia. J Periodontol. 2005;76(11 Suppl):2154-60. [ Links ]
5. Scannapieco FA, Rethman MP. The relationship between periodontal diseases and respiratory diseases. Dent Today. 2003;22(8):79-83. [ Links ]
6. Mojon P, Budtz-Jørgensen E, Michel JP, Limeback H. Oral health and history of respiratory tract infection in frail institutionalised elders. Gerodontology. 1997;14(1):9-16. [ Links ]
7. Garcia RI, Henshaw MM, Krall EA. Relationship between periodontal disease and systemic health. Periodontol 2000. 2001;25:21-36. [ Links ]
8. Bonay M, Boutten A, Leçon-Malas V, Marchal J, Soler P, Fournier M, et al. Hepatocyte and keratinocyte growth factors and their receptors in human lung emphysema. BMC Pulm Med. 2005;5:3. [ Links ]
9. Rufino R, Silva JRL. Bases celulares e bioquímicas da doença pulmonar obstrutiva crônica. J Bras Pneumol. 2006;32(3):241-8. [ Links ]
10. Bonten MJ, Bergmans DC, Ambergen AW, Leeuw PW, van der Geest S, Stobberingh EE, et al. Risk factors for pneumonia, and colonization, of respiratory tract and stomach in mechanically ventilated ICU patients. Am J Respir Crin Care Med. 1996;154(5):1339-46. [ Links ]
11. Preston AJ, Gosney MA, Noon S, Martin MV. Oral flora of elderly patients following acute medical admission. Gerontology. 1999;45(1):49-52. [ Links ]
12. Russell SL, Boylan RJ, Kaslick RS, Scannapieco FA, Katz RV. Respiratory pathogen colonization of the dental plaque of institutionalized elders. Spec Care Dentist. 1999;19(3):128-34. [ Links ]
13. Bernardon MA. Estudo da associação entre periodontite e doença pulmonar: levantamento epidemiológico [dissertação]. Passo Fundo: Hospital São Vicente de Paulo de Passo Fundo; 2006. [ Links ]
14. Scannapieco FA, Papandonatos GD, Dunford RG. Associations between oral conditions and respiratory disease in a national sample survey population. Ann Periodontol. 1998;3(1):251-6. [ Links ]
15. Löe H, Silness J. Periodontal disease in pregnancy. I. Prevalence and severity. Acta Odontol Scand. 1963;21:533. [ Links ]
16. Silness J, Löe H. Periodontal disease in pregnancy. Acta Odontol Scand. 1964;22:123. [ Links ]
17. Engebretson SP, Vossughi F, Hey-Hadavi J, Emingil G, Grbic JT. The influence of diabetes on gingival crevicular fluid beta-glucuronidase and interleukin-8. J Clin Periodontol. 2006;33(11):784-90. [ Links ]
18. Poulsen AH, Westergaard J, Stoltze K, Skjødt H, Danneskiold-Samsøe B, Locht H, et al. Periodontal and hematological characteristics associated with aggressive periodontitis, juvenile idiopathic arthritis, and rheumatoid arthritis. J Periodontol. 2006;77(2):280-8. [ Links ]
19. Santos-Pereira SA, Giraldo CP, Saba-Chujfi E, Amaral RLG, Morais SS, Fachini AM, et al. Chronic periodontitis and pre-term labour in Brazilian pregnant women: an association to be analysed. J Clin Periodontol. 2007;34(3):208-13. [ Links ]
20. Zaremba M, Górska R, Suwalski P, Kowalski J. Evaluation of the incidence of periodontitis-associated bacteria in the atherosclerotic plaque of coronary blood vessels. J Periodontol. 2007;78(2):322-7. [ Links ]
21. Mariotti A. A primer on inflammation. Compend Contin Educ Dent. 2004;25(7 Suppl 1):7-15. [ Links ]
22. Krishnan G, Grant BJ, Muti PC, Mishra A, Ochs-Balcom HM, Freudenheim JL, et al. Association between anemia and quality of life in a population sample of individuals with chronic obstructive pulmonary disease. BMC Pulm Med. 2006;6:23. [ Links ]
23. Papapanou PN. Periodontal diseases: epidemiology. Ann Periodontol. 1996;1(1):1-36. [ Links ]
24. Al-Shammari KF, Al-Khabbaz AK, Al-Ansari JM, Neiva R, Wang HL. Risk indicators for tooth loss due to periodontal disease. J Periodontol. 2005;76(11):1910-8. [ Links ]
25. Buduneli N, Kardesler L, Isik H, Willis CS, Hawkins SI, Kinane DF. Effects of smoking and gingival inflammation on salivary antioxidant capacity. J Clin Periodontol. 2006;33(3):159-64. [ Links ]
26. Hyman JJ, Reid BC. Cigarette smoking, periodontal disease: and chronic obstructive pulmonary disease. J Periodontol. 2004;75(1):9-15. [ Links ]
27. Terpenning MS, Taylor GW, Lopatin DE. Aspiration pneumonia: dental and oral risk factors in an older veteran population. J Am Geriatr Soc. 2001;49(5):557-63. [ Links ]
28. Scannapieco FA, Ho AW. Potential associations between chronic respiratory disease and periodontal disease: analysis of National Health and Nutrition Examination Survey III. J Periodontol. 2001;72(1):50-6. [ Links ]
29. Katancik JA, Kritchevsky S, Weyant RJ, Corby P, Bretz W, Crapo RO, et al. Periodontitis and airway obstruction. J Periodontol. 2005;76(11 Suppl):2161-7. [ Links ]
30. Chabrand F, Allamand JM, Duroux P, Rabate B, Laudenbach P, Doyon D. Are orodental infectious foci responsible for bacterial pneumopathies? A statistical study. Rev Stomatol Chir Maxillofac. 1998;87(2):73-7. [ Links ]
Recebido em: 31/1/2009
Versão final reapresentada em: 13/8/2009
Aprovado em: 7/10/2009
1 Correspondência para / Correspondence to: FR MACEDO. E-mail: <fabianormacedo@gmail.com>